Карбид алюминия валентность и степень окисления. Презентация на тему: Валентность и степень окисления
Валентностью элемента называется свойство (или способность) его атомов присоединять к себе (или замещать в молекулах сложных веществ) определенное число атомов другого элемента.
В соединениях с ионной связью валентность равна числу электронов, отданных или присоединенных атомом при превращении его в ион.
Валентность в ковалентных соединениях равна числу электронных пар, участвующих в образовании связи. Следовательно, валентность элемента определяется числом электронов, участвующих в образовании химических связей. Часто валентность элементов сравнивают с валентностью водорода, принятой за единицу. Например, в бромоводороде бром одновалентен; в аммиаке азот трехвалентен; в метане углерод четырехвалентен. Нередко валентность элементов определяют и из их кислородных соединений. Например, в диоксиде кремния кремний четырехвалентен, в триоксиде хрома хром шестивалентен, в тетраоксиде рутения рутений восьмивалентен.
Валентность по водороду меняется от 1 до 4 , а по кислороду от 1 до 8 . Между валентностью В, атомным весом А и эквивалентом Э существует зависимость, выражаемая соотношением:
![]()
Валентность некоторых элементов - величина постоянная. Так, например, натрий во всех соединениях одновалентен, цинк - двухвалентен, лантан - трехвалентен и т. д. Для целого ряда элементов валентность изменяется в зависимости от условий протекания процесса. Например, олово может быть двух- и четырехвалентным, медь одно-, двух- и трехвалентной, сера двух-, четырех- и шестивалентной.
Нередко валентность для наглядности обозначают соответствующим числом черточек между символами элементов и пользуются структурными формулами. Число черточек равно числу единиц валентности. Атомы в молекуле связываются между собой так, что на определенное число единиц валентности одного элемента приходится такое же число единиц валентности другого элемента.
Приведем примеры структурных формул;

Эти формулы с точки зрения ковалентной связи можно представить и так:

Валентная черточка, принятая в обыкновенных структурных формулах, соответствует одной электронной паре ковалентной связи. Химическая связь между двумя атомами в молекуле, осуществляемая одной парой электронов, называется одинарной (или простой).
Структурные формулы окиси бария, двуокиси серы и этилена имеют вид:

Здесь связь , и является двойной (бинарной).
В цианистоводородной кислоте имеется одна тройная связь и одна одинарная, а в ацетилене - одна тройная и две одинарные:
Структурную формулу азотной кислоты изображают так:

Вследствие перехода электрона от атома азота к атому кислорода у атома азота появляются четыре неспаренных электрона, способных образовать четыре химических связи.
В молекуле азотной кислоты атомы кислорода, связанные только с азотом, равноценны, поэтому и возможность перехода электронов к каждому из них одинакова. Отсюда более точно строение выражает следующая структурная формула:

Из этой формулы видно, что четвертая связь разделена поровну между атомами кислорода.
Детальное изучение структуры молекулы показывает, что она имеет следующее строение:

Электронное строение аналогично :

В соединениях, содержащих водород и кислород, атомы водорода, способные в реакциях замещаться на металл, как правило, связаны с центральным атомом не непосредственно, а. через кислород. Вокруг центрального атома, обладающего высшей валентностью, пишут столько черточек, каково число, выражающее валентность, после чего через кислород присоединяют атомы водорода, а затем к свободным черточкам, если таковые окажутся, присоединяют атомы кислорода.
Приведем структурные формулы следующих кислот

Электронное строение некоторых из этих кислот выразится формулами:

В таких кислотах, как, например, в фосфористой , фосфорноватистой и некоторых других, часть атомов водорода связана непосредственно с центральным атомом:

Эти атомы водорода в химических реакциях не замещаются атомами металлов. Этот пример показывает, какое большое значение имеют структурные формулы.
Приведем примеры структурных формул нормальных и кислых солей:

Структурные формулы двойных солей:

Структурные формулы щелочей и оснований имеют вид:

Структурные формулы основных солей, если они образованы при неполной нейтрализации гидроксидов (с валентностью от 2 и выше), можно составить, исходя из структурных формул исходных веществ

Структурные формулы основных солей:

Структурные формулы соединений дают более полное представление о рассматриваемых веществах, чем обычные, так как они показывают не только, из каких атомов состоит та или иная молекула, но и как эти атомы связаны между собой.
Структуру веществ стало возможным изучить на основе теории химического строения веществ А. М. Бутлерова (1861).
Основываясь на этой теории и периодическом законе Д. И. Менделеева, можно сказать, что химические свойства молекул, проявляющиеся при химических реакциях, определяются природой элементарных составных частей (атомов), количеством их и химическим строением, а также свойствами среды (природа растворителя, агрегатное состояние и др.) и внешними условиями.
Разумеется, молекулы разного состава и строения обладают различными химическими свойствами. Например, водород энергично взаимодействует с газообразным кислородом, тбгда как хлороводород окисляется газообразным кислородом лишь при нагревании. Следует учитывать также и то, что на химические свойства молекул оказывает влияние порядок и последовательность соединения атомов между собой. Известны, например, два соединения, молекулы которых имеют химическую формулу , но различную последовательность связей атомов: и .
Первое вещество (этиловый спирт) легко реагирует с натрием
в то время как второе (диметиловый эфир) совсем не взаимодействует с ним. Объясняется это различным влиянием атомов, непосредственно соединенных с водородом: свойства атома водорода в этиловом спирте (в связи О - Н) иные, чем в диметиловом эфире (в связи С - Н).
Примером взаимного влияния несоединенных друг с другом атомов могут служить молекулы фосгена и дихлорметана. В молекуле фосгена под влиянием кислорода (О) атомы хлора замещаются значительно легче, чем в дихлорметане .
Объясняется это также тем, что связи в молекуле фосгена имеют иную прочность и характер, чем в молекуле дихлорметана.
Периодический закон Д. И. Менделеева и теория химического строения А. М. Бутлерова дали возможность систематизировать существующие химические соединения и предвидеть многие свойства молекул, исходя из свойств образующих их атомов.
При образовании ионных связей валентные электроны переходят от менее электроотрицательных (ЭО) к более электроотрицательным атомам, в результате чего образуются ионы, заряд которых определяется количеством отданных или присоединенных электронов. В молекулах с полярными связями валентные электроны лишь частично смещаются к более ЭО атому, при этом на взаимодействующих атомах возникают электрические заряды, но их величины не являются целочисленными. Например, в молекуле HCl на водороде существует положительный, а на Cl — отрицательный заряды, но их величины меньше 1.
В практических целях (при составлении уравнений окислительно-восстановительных реакций) заряды на атомах в молекулах с полярными связями удобно представлять в виде целых чисел, равных таким зарядам, которые возникли бы на атомах, если бы валентные …
электроны полностью переходили к более электроотрицательным атомам, т.е. если бы связи были полностью ионными. Такие величины зарядов получили название степеней окисления. Степень окисления любого элемента в простом веществе всегда равна 0.
В молекулах сложных веществ некоторые элементы всегда имеют постоянную степень окисления . Для большинства элементов характерны переменные степени окисления , различающиеся как знаком, так и величиной, в зависимости от состава молекулы.
У щелочных металлов, а также у металлов главной подгруппы второй группы степень окисления во всех соединениях равна соответственно +1 и +2. Постоянную степень окисления, равную -1, имеет фтор. Кислород, как правило, имеет степень окисления -2. У водорода в соединениях с неметаллами степень окисления +1, в гидридах металлов — -1. Для того, чтобы отличить значения степени окисления от зарядов ионов в первом случае знак ставится перед цифрой, во втором — после цифры. Например, Н +1 Cl -1 , но Na 1+ Cl 1- .
Часто степень окисления (СО) равна валентности и отличается от нее только знаком. Но встречаются соединения, в которых степень окисления элемента не равна его валентности. Как уже отмечалось, в простых веществах СО элемента всегда равна нулю независимо от его валентности. В таблице сопоставлены валентности и степени окисления некоторых элементов в различных соединениях.
| соединение | элемент | валентность | схема | степень окисления |
| О 2 | кислород | О=О | ||
| Н 2 О | О Н Н | -2 +1 | ||
| Н 2 О 2 | Н→О – О←Н | -1 +1 | ||
| N 2 | азот | N≡N | ||
| NH 3 | H N H H | -3 +1 | ||
| NF 3 | F N F F | +3 -1 | ||
| N 2 H 4 (гидразин) | H H N-N H H | -2 +1 | ||
| NH 2 OH (гидроксил-амин) | H N O H H | -1 -2 +1 |
Определение степени окисления элемента в какой либо молекуле сводится к простой арифметической операции, так как сумма степеней окисления атомов всех элементов, входящих в состав молекулы, равна нулю. Например, необходимо определить степень окисления фосфора в фосфорной кислоте Н 3 РО 4 . Поскольку у кислорода СО – -2 , а у водорода — +1, то для нулевой суммы у фосфора степень окисления должна быть равна 5.
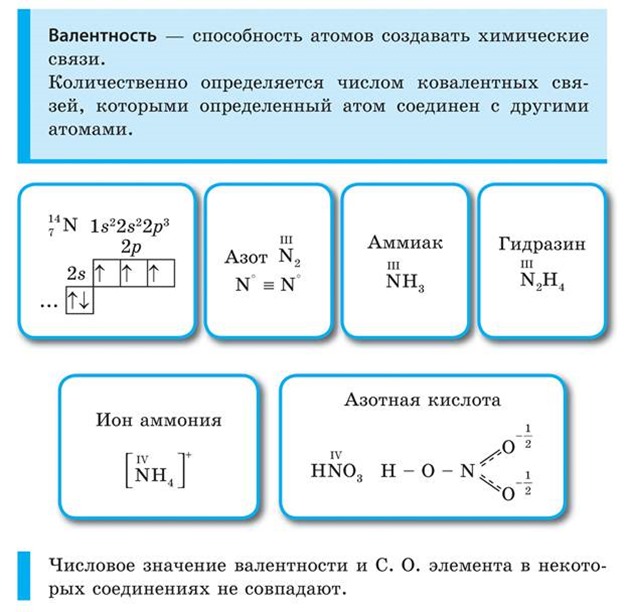
Валентность и степень окисления
Валентность - способность атомов данного элемента присоединять определенное число атомов других элементов.
Атом водородa никогда не присоединяет больше одного атома другого элемента. Поэтому валентность водорода приняли за единицу измерения валентности элементов.
Например, в соединениях: HCl - хлор одновалентен, H 2 O - кислород двухвалентен, NH 3 – азот трехвалентен, CH 4 - углерод четырехвалентен. В этих соединениях валентность элементов мы определяем по формулам водородных соединений - это валентность по водороду.
Кислород всегда имеет валентность два. Если мы знаем формулы соединений элементов с кислородом, то можно определить валентность по кислороду. Например, в следующих соединениях элементы имеют такие валентности (обозначены римскими цифрами):
Задание: Определить валентности элементов.
I II III IV V VI VII
Na 2 O, CaO, Аl 2 O 3 , СО 2 , P 2 O 5 , СrО 3 , Мn 2 О 7 .
Если мы знаем валентности элементов, то можем легко составить формулу вещества, которое состоит из двух элементов. Например, если вещество состоит из магния (валентность два) и хлора (валентность один), то формула, вещества MgCl 2 .
В молекуле сложного вещества A x B y , которое состоит из элемента A с валентностью п и элемента В с валентностью m , произведение валентности на число атомов одного элемента равно произведению валентности на число атомов другого элемента: пх = ту. Например, в молекуле Al 2 O 3 произведение валентности алюминия на число атомов равно произведению валентности кислорода на число его атомов (3 ´ 2 = 2 ´ 3).
Валентность - важная качественная характеристика элемента.
Графическое изображение формул. Формулы молекул можно изображать графически. В графических изображениях формул каждую валентность обозначают при помощи черты. Например, графическое изображение формулы
Н 2 О (молекулы воды) H - O - H,
формулы CO 2 (оксида углерода, (IV)) O = С = O,
формулы Al 2 O 3 (оксида алюминия) О = А1 – O – Al = О.
Электронная теория строения атома объяснила физический смысл валентности и структурных формул.
Валентность элемента определяется числом общих электронных пар, которые связывают атом данного элемента с другими атомами.
Валентность не может быть отрицательной и не может равняться нулю. Понятие «валентность» можно применять только к соединениям с ковалентной связью.
Для характеристики состояния атома в соединении используют понятие «степень окисления».
Степень окисления - это условный заряд атома в молекуле, который возник бы на атоме, если бы общие электронные пары полностью сместились к более электроотрицательному атому (т.е. атомы превратились бы в ионы).
Степень окисления не всегда численно равна валентности. Для определения степени окисления каждого элемента в соединении нужно помнить следующее:
1. Степень окисления атома в молекуле может быть равна нулю или выражена отрицательным или положительным числом.
2. Молекула всегда электронейтральна: сумма положительных и отрицательных формальных зарядов, которые характеризуют степень окисления атомов, образующих молекулу, равна нулю.
3. Степень окисления водорода во всех соединениях, за исключением гидридов металлов (NaH, KH, CaH 2 и др.), равна + 1. В гидридах металлов его степень окисления равна – 1.
4. Степень окисления кислорода в большинстве соединений равна - 2. Исключения составляют:
а) пероксиды типа H 2 О 2 , Na 2 O 2 , BaO 2 , в которых степень окисления кислорода равна – 1; а его валентность равна двум (H - О - О ¾ H,
Na - O - O - Na).
б) надпероксиды типа KO 2 , RbO 2 , CsO 2 , в которых степень окисления
-1 имеет сложный надпероксидный ион [О 2 ] -1 и, следовательно, формально степень окисления атома кислорода равна – ½;
в) озониды типа KO 3 , RbO 3 , CsO 3 , в которых степень окисления -1 имеет сложный озонид-ион [О 3 ] -1 и, следовательно, формально степень окисления атома кислорода равна – 1/3;
г) смешанные пероксид-надпероксидные соединения типа М 2 О 3 (М 2 О 2 ×2МО 2), где М – K, Rb, Cs, в которых атомы кислорода формально характеризуются степенями окисления -1 и – ½;
д) оксид F 2 O и пероксид F 2 O 2 фтора, в которых степень окисления атомов кислорода соответственно равна +2 и +1.
5. Степень окисления атомов в простых веществах равна нулю:
С1 2 , Н 2 , N 2 , P 4 , S 8 .
6. Степень окисления атомов металлов в соединениях всегда положительна. При этом многие из них имеют постоянную степень окисления. Например, атомы щелочных металлов (Li, Na, К, Rb, Cs, Fr) во всех соединениях имеют степени окисления + 1, а атомы щелочноземельных металлов (Ca, Sr, Ba, Ra) - степени окисления +2.
7. Степени окисления многих элементов переменные.
Например, степень окисления серы в сероводороде H 2 S равна - 2, в оксиде серы (IV) SO 2 + 4, в оксиде серы (VI) SO 3 + 6.
8. Высшая степень окисления элемента обычно равна номеру группы, в которой находится элемент в периодической системе элементов.
Например, магний Mg находится во второй группе и его высшая степень окисления равна + 2. Марганец Mn находится в седьмой группе и его высшая степень окисления равна + 7.
9. Зная степени окисления одних элементов, можно определить степени окисления других элементов в данном соединении. Для этого нужно помнить, что алгебраическая сумма степеней окисления всех элементов в соединении (с учетом числа атомов) всегда равна нулю.
Например, определим степень окисления азота в азотной кислоте HNO 3 и в азотистой кислоте HNО 2 . В азотной кислоте степень окисления водорода +1, кислорода -2, степень окисления азота х:
1 +x + (-2 ´ 3) = 0,
В азотистой кислоте степень окисления азота:
1 + x + (-2 ´ 2) = 0,
Электроотрицательность
В химии широко применяется понятие электроотрицательности (ЭО) .
Свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электроотрицательностью.
Электроотрицательность лития условно принимается за единицу, ЭО других элементов вычисляют соответственно. Существует шкала значений ЭО элементов.
Числовые значения ЭО элементов имеют приблизительные значения: это безразмерная величина. Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства. По ЭО элементы можно записать следующим образом:
$F > O > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs$. Наибольшее значение ЭО имеет фтор.
Сопоставляя значения ЭО элементов от франция $(0,86)$ до фтора $(4,1)$, легко заметить, что ЭО подчиняется Периодическому закону.
В Периодической системе элементов ЭО в периоде растет с увеличением номера элемента (слева направо), а в главных подгруппах — уменьшается (сверху вниз).
В периодах по мере увеличения зарядов ядер атомов число электронов на внешнем слое увеличивается, радиус атомов уменьшается, поэтому легкость отдачи электронов уменьшается, ЭО возрастает, следовательно, усиливаются неметаллические свойства.
Степень окисления
Сложные вещества, состоящие из двух химических элементов, называют бинарными (от лат. би — два ), или двухэлементными.
Вспомним типичные бинарные соединения, которые приводились в качестве примера для рассмотрения механизмов образования ионной и ковалентной полярной связи: $NaCl$ — хлорид натрия и $HCl$ — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом $+1$, а атом хлора принял электрон и превратился в ион с зарядом $-1$. Схематически процесс превращения атомов в ионы можно изобразить так:
${Na}↖{0}+{Cl}↖{0}→{Na}↖{+1}{Cl}↖{-1}$.
В молекуле же $HCl$ связь образуется за счет спаривания неспаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного $s$-облака атома водорода одноэлектронным $р$-облаком атома хлора:
При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора: ${H}↖{δ+}→{Cl}↖{δ−}$, т.е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов $δ$: $H^{+0,18}Cl^{-0,18}$. Если же представить, что и в молекуле $HCl$, как и в хлориде $NaCl$, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды $+1$ и $-1$: ${H}↖{+1}{Cl}↖{−1}. Такие условные заряды называют степенью окисления. При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных атомов.
Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно ставится над символом элемента сверху, например:
${Na_2}↖{+1}{S}↖{-2}, {Mg_3}↖{+2}{N_2}↖{-3}, {H_3}↖{-1}{N}↖{-3}, {Cl_2}↖{0}$.
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т.е. атомы более электроотрицательных элементов.
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т.е. атомы менее электроотрицательных элементов.
Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии.
В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора: $Cl_2O_7$. Обозначим степень окисления кислорода: ${Cl_2}{O_7}↖{-2}$. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд $(-2)·7=-14$. Тогда общий заряд двух атомов хлора равен $+14$, а одного атома хлора $(+14):2=+7$.
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например, карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия и углерода рядом — $AlC$, причем сначала — знак алюминия, т.к. это металл. Определим по таблице элементов Менделеева число внешних электронов: у $Al$ — $3$ электрона, у $С$ — $4$. Атом алюминия отдаст свои три внеш них электрона углероду и получит при этом степень окисления $+3$, равную заряду иона. Атом углерода, наоборот, примет недостающие до «заветной восьмерки» $4$ электрона и получит при этом степень окисления $-4$. Запишем эти значения в формулу $({Al}↖{+3}{C}↖{-4})$ и найдем наименьшее общее кратное для них, оно равно $12$. Затем рассчитаем индексы:

Валентность
Очень важное значение в описании химического строения органических соединений имеет понятие валентности.
Валентность характеризует способность атомов химических элементов к образованию химических связей; она определяет число химических связей, которыми данный атом соединен с другими атомами в молекуле.
Валентность атома химического элемента определяется, в первую очередь, числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные возможности атомов определяются:
- числом неспаренных электронов (одноэлектронных орбиталей);
- наличием свободных орбиталей;
- наличием неподеленных пар электронов.
В органической химии понятие «валентность» замещает понятие «степень окисления», с которым привычно работать в неорганической химии. Однако это не одно и то же. Валентность не имеет знака и не может быть нулевой, тогда как степень окисления обязательно характеризуется знаком и может иметь значение, равное нулю.
В химии широко применяется понятие электроотрицательности (ЭО) — свойство атомов данного элемента оттягивать на себя электроны от атомов других элементов в соединениях называют электроотрицательностью. Электроотрицательность лития условно принимается за единицу, ЭО других элементов вычисляют соответственно. Имеется шкала значений ЭО элементов.
Числовые значения ЭО элементов имеют приблизительные значения: это безразмерная величина . Чем выше ЭО элемента, тем ярче проявляются его неметаллические свойства. По ЭО элементы можно записать следующим образом:
F > O > Cl > Br > S > P > C > H > Si > Al > Mg > Ca > Na > K > Cs

Наибольшее значение ЭО имеет фтор. Сопоставляя значения ЭО элементов от франция (0,86) до фтора (4,1), легко заметить, что ЭО подчиняется Периодическому закону. В Периодической системе элементов ЭО в периоде растет с увеличением номера элемента (слева направо), а в главных подгруппах - уменьшается (сверху вниз). В периодах по мере увеличения зарядов ядер атомов число электронов на внешнем слое увеличивается, радиус атомов уменьшается, поэтому легкость отдачи электронов уменьшается, ЭО возрастает, следовательно, усиливаются неметаллические свойства.

Разность электроотрицательностей элементов в соединении (ΔX) позволит судить о типе химической связи.
Если величина Δ X = 0 – связь ковалентная неполярная.
При разности электроотрицательностей до 2,0 связь называют ковалентной полярной , например: связь H-F в молекуле фтороводорода HF: Δ X = (3,98 – 2,20) = 1,78
Связи с разностью электроотрицательностей больше 2,0 считаются ионными. Например: связь Na-Cl в соединении NaCl: Δ X = (3,16 – 0,93) = 2,23.
Электроотрицательность зависит от расстояния между ядром и валентными электронами, и от того, насколько валентная оболочка близка к завершенной. Чем меньше радиус атома и чем больше валентных электронов, тем выше его ЭО.
Фтор является самым электроотрицательным элементом . Во-первых, он имеет на валентной оболочке 7 электронов (до октета недостает всего 1-го электрона) и, во-вторых, эта валентная оболочка расположена близко к ядру.
 Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов.
Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем “добирать” электроны.
Менее всего электроотрицательны атомы щелочных и щелочноземельных металлов.
Они имеют большие радиусы и их внешние электронные оболочки далеки от завершения. Им гораздо проще отдать свои валентные электроны другому атому (тогда предвнешняя оболочка станет завершенной), чем “добирать” электроны.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют шкалу электроотрицательностей, предложенную американским химиком Л. Полингом.
Степень окисления
Сложные вещества, состоящие из двух химических элементов, называют бинарными (от лат. би - два), или двухэлементными (NaCl, HCl). В случае ионной связи в молекуле NaCl атом натрия передает свой внешний электрон атому хлора и превращается при этом в ион с зарядом +1, а атом хлора принимает электрон и превращается в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:

При химическом взаимодействии в молекуле HCl общая электронная пара смещается в сторону более электроотрицательного атома.
Например, , т. е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ:
Н +0.18 Сl -0.18 . Если же представить, что и в молекуле HCl, как и в хлориде NaCl, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды +1 и -1:
, т. е. электрон не полностью перейдет от атома водорода к атому хлора, а частично, обусловливая тем самым частичный заряд атомов δ:
Н +0.18 Сl -0.18 . Если же представить, что и в молекуле HCl, как и в хлориде NaCl, электрон полностью перешел от атома водорода к атому хлора, то они получили бы заряды +1 и -1:
Такие условные заряды называют степенью окисления . При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных атомов.
Степень окисления - это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов. Степень окисления может иметь отрицательное, положительное или нулевое значение, которое обычно ставится над символом элемента сверху, например:
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов или к которым смещены общие электронные пары, т. е. атомы более электроотрицательных элементов . Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, т. е. атомы менее электроотрицательных элементов . Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы в свободном состоянии, например:
![]()
В соединениях суммарная степень окисления всегда равна нулю.



Валентность
Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные возможности атомов определяются:
Числом неспаренных электронов (одноэлектронных орбиталей);
Наличием свободных орбиталей;
Наличием неподеленных пар электронов.
В органической химии понятие «валентность» замещает понятие «степень окисления», с которым привычно работать в неорганической химии. Однако это не одно и то же. Валентность не имеет знака и не может быть нулевой, тогда как степень окисления обязательно характеризуется знаком и может иметь значение, равное нулю.
В основном, под валентностью понимается способность атомов к образованию определённого числа ковалентных связей. Если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами, т.е. его валентность будет равна n + m. При оценке максимальной валентности следует исходить из электронной конфигурации «возбуждённого» состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4.
Постоянные валентности:
- H, Na, Li, К, Rb, Cs — Степень окисления I
- О, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd — Степень окисления II
- B, Al, Ga, In — Степень окисления III
Переменные валентности:
- Сu - I и II
- Fe, Со, Ni -II и III
- С, Sn, Pb - II и IV
- P- III и V
- Cr - II, III и VI
- S - II, IV и VI
- Mn-II, III, IV, VI и VII
- N-II, III, IV и V
- Cl-I, IV, VI и VII
Используя валентности можно составить формулу соединения.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
Например: Н 2 O-формула воды, где Н и О-химические знаки элементов, 2 — индекс, который показывает число атомов данного элемента, входящих в состав молекулы воды.
При названии веществ с переменной валентностью обязательно указывается его валентность, которая ставится в скобки. Например, Р 2 0 5 — оксид фосфора (V)
I. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю — Na 0 , Р 4 0 , О 2 0
II. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0. а в сложном ионе его заряду.
Например:

Разберем для примера несколько соединений и узнаем валентность хлора :

Справочный материал для прохождения тестирования:
Таблица Менделеева
Таблица растворимости