Определение валентности химических элементов. Знаешь как
ОПРЕДЕЛЕНИЕ
Водород - бесцветный газ, не имеющий запаха.
При температуре ниже -240 o С (критическая температура водорода) он под давлением сжижается. Если испарять полученную жидкость, то образуется твердый водород в виде прозрачных кристаллов, плавящихся при -259,2 o С.
Водород - самый легкий из всех газов, он в 14,5 раз легче воздуха; масса 1 л водорода при нормальных условиях равна 0,09 г. В воде водород растворим очень мало, но в некоторых металлах, например в никеле, паладии, платине, растворяется в значительных количествах.
Водород имеет три изотопа: протий 1 H, дейтерий 2 H или D и тритий 3 H или T. Их массовые числа равны 1, 2 и 3. Протий и дейтерий стабильны, тритий - радиоактивен. Ядро атома водорода 1 H содержит один протон. Ядра дейтерия и трития включают кроме одного протона соответственно один и два нейтрона.
Молекула водорода состоит из двух атомов - H 2 .
Валентность водорода в соединениях
В ядре атома водорода содержится один протон, а по единственной орбите вокруг него движется один электрон (рис. 1).
Рис. 1. Строение атома водорода.
Электронная формула атома водорода в основном состоянии будет выглядеть следующим образом:
А энергетическая диаграмма:
Наличие одного неспаренного электрона свидетельствует о том, что для водорода характерна валентность равная I. Этот факт также подтверждается и тем, что водород расположен в IA группе Периодической таблицы Д.И. Менделеева, а, как известно, высшая валентность химического элемента определяется номером группы, в которой он находится. Валентность водорода постоянна во всех соединениях (BaH I 2 , H I Cl, NaOH I , Ca(H I CO 3) 2 и т.д.)
Примеры решения задач
ПРИМЕР 1
| Задание | Могут ли реагировать между собой бинарные водородные соединения? Дайте обоснованный ответ. Приведите уравнения возможных реакций на примере водородных соединений элементов второго и третьего периодов Периодической системы. |
| Ответ | Бинарные водородные соединения элементов второго и третьего периодов могут вступать во взаимодействие друг с другом, проявляя как кислотно-основные, так и окислительно-восстановительные свойства. Например, между собой реагируют:
В этих реакциях аммиак и фосфин проявляют свойства оснований, а вода, хлороводород и фтороводород - свойства кислот. Окислительно-восстановительные реакции протекают при взаимодействии гидридов лития и натрия с водой, хлороводородом и сероводородом: В этих реакциях гидриды металлов выступают в роли восстановителей, а вода, хлороводород и сероводород - в роли окислителей. |
ОПРЕДЕЛЕНИЕ
Натрий - элемент первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11.
Натрий представляет собой серебристо-белый металл. Он настолько мягок, что легко режется ножом. Вследствие легкой окисляемости на воздухе натрий хранят под слоем керосина. Легкий - плотность равна 0,97 г/см 3 . Температуры плавления и кипения относительно невысоки 97,8 o С и 882,9 o С, соответственно.
Валентность натрия в соединениях
Натрий — одиннадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в IA группе. В ядре атома натрия содержится 11 протонов и 12 нейтронов (массовое число равно 23). В атоме натрия есть три энергетических уровня, на которых находятся 11 электронов (рис. 1).
Рис. 1. Строения атома натрия.
Электронная формула атома натрия в основном состоянии имеет следующий вид:
1s 2 2s 2 2p 6 3s 1 .
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие одного единственного неспаренного электрона свидетельствует о том, что натрий проявляет валентность I в своих соединения (Na I 2 O, Na I OH, Na I Cl, CH 3 COONa I , Na I 3 PO 4 и т.д.). Валентность натрия постоянная.
Примеры решения задач
ПРИМЕР 1
ПРИМЕР 2
| Задание | К 200-м граммам 5%-го раствора хлорида натрия добавили 15 г этой же соли и столько же граммов воды. Чему стала равна массовая доля хлорида натрия в получившемся растворе? |
| Решение | Решение задачи следует начать с записи формулы для вычисления массовой доли растворенного вещества:
ω = m solute / m solution × 100%; Найдем массу растворенного вещества хлорида натрия в изначальном растворе: m solute = ω / 100% ×m solution ; m solute (NaCl) = ω (NaCl) / 100% ×m solution ; m solute (NaCl) = 5 / 100% × 200 = 10 г. Рассчитаем массу нового раствора: m solution (new) = m solute + m(NaCl) + m (H 2 O); m solution (new) = 200 + 15 + 15 = 230 г. Найдем общую массу растворенного хлорида натрия и его массовую долю в новом растворе: m(NaCl) sum = m solute (NaCl) + m(NaCl); m(NaCl) sum = 10 + 15 = 25г. ω (NaCl) new = m(NaCl) sum / m solution (new) × 100%; ω (NaCl) new = 25 / 230 × 100% = 11%. |
| Ответ | Получится 11%-й раствор хлорида натрия. |
Цель: Дать учащимся понятие о валентности как свойстве атомов присоединять определённое число атомов другого элемента, научить их определять валентность элементов по формулам их соединений.
Задачи: 1)Образовательные:
Добиться усвоения понятия валентность;
Научить определять валентность элементов по
формулам их соединений;
Повторить, углубить знания о строении вещества;
2)Воспитательные:
Дополнить мировоззрение учащихся знаниями о валентности;
Продолжить эстетическое воспитание;
3)Развивающие:
Продолжить развитие отдельных логических операций и логического мышления в целом;
Продолжить развитие познавательного интереса.
Тип урока: Изучение нового материала
Структура
Урока: 1)Повторение пройденного материала не на оценку. (2 мин.)
2)Актуализация знаний. (1 мин)
3)Изучение нового материала. (20-25 мин)
4)Закрепление нового материала. (7 мин)
5)Домашнее задание. (2-3 мин)
6)Подведение итогов. (1-2 мин)
организации
обучения: Объяснительно-иллюстративные:
Устное изложение;
Рассказ;
Работа с литературой;
Оборудование
реактивы: На демонстрационном столе шаростержневые модели веществ, таблица “Постоянные значения валентности некоторых элементов”.
Ход урока:
Учитель: Добрый день!
Начнём наше занятие с повторения, пройденного ма- териала. Скажите, какие по составу вещества вы знаете?
Ученик: Вещества бывают простые и сложные.
Учитель: А чем они различаются?
Ученик: Простые вещества состоят из атомов одного вида, а сложные из атомов разного вида. В химических реакциях сложные вещества могут разлагаться с образованием нескольких других, а простые нет.
Учитель: Чем различаются сложные вещества и смеси?
Ученик: Отличие сложных веществ от смесей состоит в том, что смеси могут включать в себя несколько веществ как сложных, так и простых.
Учитель: Сравните молекулу воды и молекулу пероксида водорода H 2 O 2 по их относительным молекулярным массам.
Ученик: Относительная молекулярная масса воды равна
18 г/моль, а относительная молекулярная масса пероксида водорода равна 34 г/моль.
Учитель: Вычислите массовую долю кислорода в пероксиде водорода.
Ученик: M r (H 2 O 2)= 1*2+16*2=34 (г/моль).
34 масс. ч. пероксида водорода соответствуют 1
32 масс. ч. кислорода соответствуют x
34:32=1:x
x =32*1/34=0,9412, или 94,12%
Учитель: Молодцы! Вижу, что вы хорошо усвоили материал предыдущих занятий. Теперь расскажите о качественном и количественном составе этих веществ (формулы на доске в столбик) HCl, H 2 O, NH 3 , CH 4 .
Ученик: HCl-состоит из одного атома водорода и одного атома хлора;
H 2 O-состоит из двух атомов водорода и одного атома кислорода;
NH 3 -состоит из трёх атомов водорода и одного атома азота;
CH 4 -состоит из четырёх атомов водорода и одного атома углерода;
Учитель: Хорошо. Сейчас же возникает вопрос-проблема: почему атомы разных элементов удерживают неодинаковое число атомов водорода? Видимо, атомы обладают разной способностью в этом отношении. Сегодня об этом мы и узнаем, тема урока “Валентность” (тема пишется на доске). Как видно из приведённых примеров, атомы элементов хлора, кислорода, азота, углерода обладают свойством присоединять не любое, а только определённое число атомов водорода. Таким же свойством обладают и другие элементы в различных соединениях. Может кто-нибудь попробует дать определение валентности?
Ученик: Валентность-это свойство атомов химического элемента присоединять определённое число атомов других химических элементов.
Учитель: Молодец, правильно. Обратите внимание на то, что атомы различных элементов могут присоединять разное число атомов водорода, а каждый атом водорода, в свою очередь, образует связь только с одним атомом другого элемента. Отсюда следует вывод о наименьшей валентности водорода. Во всех соединениях она постоянна и её значение принято считать за единицу. Запишите это в тетрадь.
(Записываю на доске, а ученики в тетради)
HCl-атом хлора удерживает один атом водорода, хлор одновалентен
H 2 O-атом кислорода удерживает два атома водорода, кислород двухвалентен
NH 3 -атом азота удерживает три атома водорода, азот трёхвалентен
CH 4 -атом углерода удерживает четыре атома водорода, углерод четырёхвалентен
(одновременно демонстрирую шаростержневые модели молекул этих веществ, и пишу их структурные формулы)
Теперь мы рассмотрим, как определять валентность элементов. В любом веществе, состоящем из двух элементов (такие соединения называются бинарными), сумма единиц валентности всех атомов одного элемента равна сумме единиц валентности всех атомов другого элемента. Так как водород одновалентен, то в бинарном водородном соединении значение валентности второго элемента равно числу атомов водорода. (Расставляю над формулами водородных соединений на доске значение валентности римскими цифрами) В графических формулах каждая чёрточка соответствует единице валентности. (На доске)
1-обозначена валентность водорода
n-известное число атомов (индекс).
Требуется определить валентность другого элемента (A), которая обозначена x. Как это сделать? “Чтоб валентность элемента в данной формуле узнать, надо рядом с элементом водород пересчитать, римской цифрою представить и над символом поставить ” . (Дописываю на доске правую часть схемы) x =? 1 x=1 1
Кислород во всех соединениях тоже имеет постоянное численное значение валентности равное двум. Зная это, можно определять валентность элементов в оксидах. Рассмотрим формулы оксидов азота N 2 O, NO, N 2 O 3 , NO 2 . Определите валентность азота в этих соединениях.
Ученик: Валентность азота 1, 2, 3, 4 соответственно.
Учитель: Как мы видим, некоторые элементы могут проявлять переменную валентность даже в соединениях с одним и тем же элементом. Давайте напишем обобщающую схему:
Как нам найти x?
Ученик: x=2n/m
Учитель: x =? 2 x=2n/m 2
“Если рядом с элементом кислород (двухвалентен он, не то, что водород), сумму всех его валентностей найди и на индекс элемента раздели”.
Для того чтобы определить валентность элементов по формулам других бинарных соединений (более общий случай), значение валентности одного из элементов обязательно должно быть известно: если значение постоянно, ученик обязан его знать, а если переменно - оно должно быть указано над химическим знаком в формуле.
А как здесь определить x?
Ученик: x=bn/m
Учитель: x=? b x=bn/m b
A m B n A m B n
Обобщите все три схемы.
Ученик: Последний графический алгоритм – основной, а 1 и 2 – лишь частные его случаи.
Учитель: “Действуй также в каждом случае ином, только помни непременно об одном: чтоб успешно все заданья выполнять, постоянную валентность нужно знать!” (Демонстрирую таблицу с постоянными значениями валентности некоторых элементов). Запомнить численные значения постоянной валентности металлов поможет нехитрый текст, комментирующий эту таблицу:”натрий, калий, серебро с водородом заодно. С кислородом – магний, ртуть, кальций, барий и бериллий, с ними цинк не позабудь. Трёхвалентен алюминий”. Валентность разных элементов в соединениях может принимать значения от 1 до 7.
Для закрепления материала определите валентность элементов в соединениях:
Вариант 1: SiH 4 , CrO 3 , Na 2 O.
Вариант 2: H 2 S, CO 2 , SO 3 .
Ученик: Вариант 1: 4 1 6 2 1 2
SiH 4 , CrO 3 , Na 2 O.
Вариант 2: 1 2 4 2 6 2
H 2 S, CO 2 , SO 3 .
Учитель: Домашнее задание: выучить § .Выполните упражнения (с.).
Сегодня на уроке мы узнали, что такое валентность и научились определять валентность элементов по формулам их соединений, узнали, что валентность может быть переменной и постоянной, запомнили несколько значений постоянной валентности некоторых элементов.
На этом наш урок заканчивается. Досвидания.
Литература:
1)Программа курса химии 8-11 классов общеобразовательных учреждений. – М.: Просвещение, 1992.
2)Рудзитис Г.Е. и др. Химия 8-класс.-М.: Просвещение, 1992.
3)Химия в школе. Супоницкая И.И. Использование алгоритмов при изучении валентности. N 199 .
Подробности Категория: Просмотров: 872
ВАЛЕНТНОСТЬ , число, указывающее, сколько атомов водорода может присоединить или заместить атом данного элемента. Учение о валентности в более широком смысле, однако, рассматривает также и весь вопрос о природе химических сил. После того как Дальтон в 1802 г. ввел в химию учение об атомах, на химические соединения стали смотреть, как на собрания множества химических частиц или молекул, из которых каждая построена из атомов. Применение закона Авогадро вместе с химическим анализом позволило далее определить количество атомов каждого рода, входящих в состав молекулы. При этом было установлено характерное различие между атомами различных элементов.
В то время как некоторые элементы, например, Cl, Вг, J, способны удержать не больше одного атома водорода: Сl-Н, Вr-Н, J-Н, атом кислорода соединяется с двумя, атом азота - с тремя, атом углерода - с четырьмя атомами водорода:
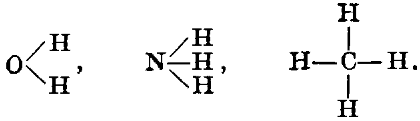
Под валентностью , значностью , атомностью подразумевается число, показывающее, со сколькими атомами водорода способен соединиться атом данного элемента, или сколько атомов водорода он способен заместить. Таким образом хлор одновалентен в НСl, кислород двухвалентен в Н 2 O, азот трехвалентен в NH 3 , углерод четырехвалентен в СН 4 . Очевидно, что мерой валентности могут служить не только водород , но и другие одновалентные атомы. Так, состав молекулы хлористого натрия NaCl приводит нас к заключению, что натрий одновалентен; из формул СаСl 2 , АlСl 3 , РСl 5 мы заключаем о двухвалентности кальция, о трехвалентности алюминия , о пятивалентности фосфора . К такому же результату мы придем, если в качестве меры возьмем атом кислорода с валентностью, равной 2. В этом случае придется исходить из состава окислов, например: Na 2 O, СаО, Аl 2 O 3 , Р 2 O 5 . Наконец, к тем же числам приводит и рассмотрение процессов замещения. Так, валентности натрия, кальция, алюминия м. б. выведены из того факта, что атом Na замещает в кислотах один атом водорода, Са - два и Аl - три атома водорода.
Если некоторые исследователи (например, Кольбе) придавали этим числам лишь описательное значение, то впоследствии, следуя Кекуле, в них уже стали непосредственно усматривать число отдельных сил или единиц сродства, действующих от атома к атому и взаимно насыщающих друг друга. Число это для каждого данного элемента принималось постоянным. «Валентность есть одно из основных свойств атома, столь же постоянное и неизменное, как сам атомный вес» (Кекуле, 1861 г.). Допущение Кекуле, что атом углерода обладает 4 такими единицами сродства и последовательное применение вытекающих отсюда структурных формул привели к блестящему развитию органической химии. Свое завершение теория Кекуле получила в стереохимии, разработавшей идею о пространственном расположении этих 4 единиц сродства. В области неорганической химии результаты были менее благоприятны: представление о постоянной валентности оказалось здесь несостоятельным. Большое количество фактов говорило за то, что валентность одного и того же элемента может принимать различные числовые значения. Так, хлор одновалентен в НСl и семивалентен в Сl 2 O 7 , фосфор трехвалентен в РСl 3 и пятивалентен в РСl 5 , сера двухвалентна в H 2 S, четырехвалентна в SO 2 и шестивалентна в SF 6 , в SO 3 и в H 2 SO 4 . Все же была найдена общая основа для всей неорганической и органической химии, которая и составляет содержание старой теории валентности. Носителем всех свойств индивидуального химического соединения является молекула, образующая замкнутую в себе систему. Атомы удерживаются в молекуле благодаря взаимному насыщению своих валентностей. Химическая реакция сводится к сцеплению атомных валентностей с предварительным расторжением уже существовавших связей. Отсюда вытекает принципиальное отличие химических процессов от чисто физических, при которых молекулы остаются неизмененными. Химические молекулы отождествляются с кинетическими, что еще более укрепляет тот взгляд, что молекула, как замкнутая единица определенного состава, существует также и в других агрегатных состояниях, при всяких иных условиях. Энергетические явления при химической реакции приписываются энергии взаимного насыщения валентностей. Количественно энергия эта сильно меняется в зависимости от свойств участвующего в реакции элемента; в случае натрия и хлора, например, взаимное насыщение одной единицы валентности сопровождается большим выделением энергии, чем в случае йода и хлора. Качественно существует, однако, лишь один вид сродства (унитарная теория), действующего непосредственно от одного атома к другому в виде отдельных направленных сил. После крушения электрической теории сродства, предложенной Берцелиусом в 1819 г., вопрос о природе химической силы оставался открытым. Известно о ней только то, что она действует лишь на малых расстояниях. Таковы основы старой теории валентности, господствовавшей во второй половине прошлого века. Недооценка таких явлений, как электролиз и игнорирование электрической полярности между элементами при образовании соединений, объясняется главным образом преобладающим влиянием органической химии, в которой указанные явления играли второстепенную роль.
За последние десятилетия накапливалось все больше и больше фактов, противоречащих старой теории. Если это противоречие менее сказывалось в области органической химии, на почве которой и выросла старая теория, то в неорганической химии оно привело к принципиально новым взглядам, легшим в основу новейших представлений о природе валентности, принятых современной физикой и химией. Для ясности попытаемся лишь схематично ответить на следующие три основных вопроса: почему представление об отдельных направленных силах не могло быть удержано? в чем сказалась несостоятельность унитарной теории, признающей лишь один вид сродства? в какой мере преувеличено было значение химической молекулы? Новые взгляды в неорганической химии были следствием, в первую очередь, развития двух областей: учения об ионах и координационной теории. Электрохимия, рассматривавшаяся ранее как обособленная область, после установления Аррениусом в 1887 г. теории электролитической диссоциации , становится в центре внимания. Успех этой теории, утверждающей, что при простом растворении в воде - процессе чисто физическом - такая молекула, как NaCl, перестает существовать, распадаясь на противоположно заряженные частицы натрия и хлора, не мог не оказать глубокого влияния на основные допущения старой теории валентности. Определения молекулярного веса показали, что в водных растворах электролитов кинетические молекулы не соответствуют химическим, выражаемым обычными формулами. Из изучения электролиза вытекало далее, что при выделении элемента из раствора сильного электролита преодолевать приходится в сущности его сродство к электричеству, электросродство (Абегг и Бодлендер), а не сродство атома к атому (потенциал, при котором, например, медь выделяемся из растворов медных солей, практически не зависит от характера аниона). Отсюда был сделан вывод о важном значении электрических зарядов в таких гетерополярных соединениях , в противоположность гомеополярным , в которых влияние их сказывается менее. Критерием полярности служит, в первую очередь, наличие ионизации, хотя бы и минимальной. Заряды эти, по-видимому, должны существовать и в недиссоциированном состоянии. Они не насыщают какие-либо валентности, а сами являются этими валентностями. Поэтому, в согласии с законом Фарадея, валентность соответствует количеству электрических зарядов отдельных ионов. Отсюда - принципиальное различие между положительной и отрицательной валентностями. В NaCl натрий обладает положительной валентностью, равной единице, хлор - отрицательной валентностью, также равной единице; валентность же свободного атома натрия равна нулю. В противоположность взгляду Берцелиуса, атомы Na и Сl соединяются не под действием уже готовых электрических зарядов, а благодаря стремлению получить таковые (электросродство). Так. обр. связь заряженных атомов в молекуле - по существу электростатического характера. Под влиянием высокой диэлектрической постоянной воды связь эта настолько ослабляется, что заряженные частицы получают свободу движения (Нернст). Абеггу мы обязаны также установлением важного соотношения между максимальной положительной (кислородной) валентностью и отрицательной (водородной) валентностью, сумма которых равна 8.
Представление об электросродстве, высказанное Абеггом и Бодлендером, не привело, однако, к упразднению старой теории. Довольно долго обе точки зрения существуют одна наряду с другой; отсюда - ряд противоречий. Такой процесс, как вытеснение одного элемента другим, например, действие хлора на йодистый водород, формулируется для растворов, по ионной теории, как явление, связанное с электросродством:
аналогичные реакции вне раствора рассматриваются в духе старой теории как перемена связей в молекулах, как насыщение валентности:
Однако ясно, что объяснение в обоих случаях должно быть единым. Во всех таких случаях первичный и существенный процесс должен состоять в перезарядке, а образование молекул в тех случаях, где они имеют значение, представляет собой вторичный процесс. Несмотря на наглядность таких представлений, первый сокрушительный натиск на старую теорию был направлен не отсюда, а со стороны чисто препаративной неорганической химии.
Реформа эта связана главн. обр. с именем Альфреда Вернера. Огромный экспериментальный материал, систематизированный Вернером и его школой, указывал на то, что способность атома проявлять сродство не исчерпывается его максимальной валентностью. Напротив, как правило, соединения первого порядка (состоящие из двух элементов) способны еще соединяться между собой, образуя соединения высшего порядка . Приведем несколько примеров:
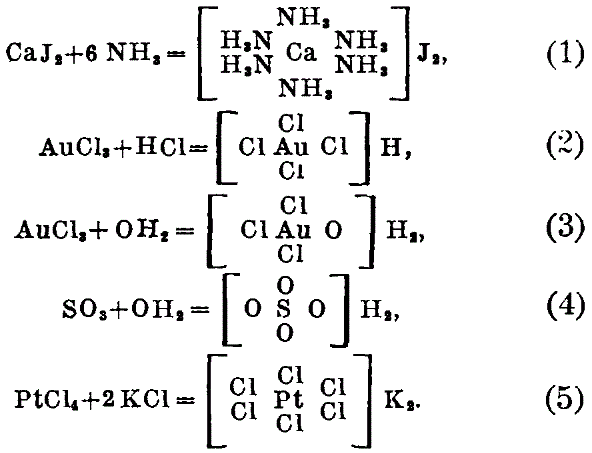
Способность эта является столь общей, а аналогия между высшими галоидными и высшими окисными соединениями - столь полной, что прежняя теория, которая не может дать единого толкования для образования химических соединений, с точки зрения Вернера, должна быть признана принципиально ошибочной. Ошибку Вернер усматривал в догме об отдельных направленных силах. Взамен этого он выставил следующее положение (1891 г.): «сродство есть сила притяжения, действующая равномерно из центра атома по направлению ко всем частям его поверхности». Сфера действия атома - шар. Нет никаких предсуществующих отдельных единиц валентности; способность же каждого атома удерживать около себя лишь строго определенное число атомов других элементов находится в зависимости от того обстоятельства, что, с одной стороны, силы притяжения между атомами (силы сродства) действуют заметно лишь на малых расстояниях и, с другой стороны - в непосредственной близости от данного атома (во внутренней сфере) может поместиться только ограниченное количество других атомов или групп. Таким образом, по Вернеру, валентность тесно связана с заполнением пространства, точнее - с относительными размерами сфер влияния частиц, сочетающихся между собой. Только таким путем можно объяснить, что атомы в различных уже готовых соединениях находятся во взаимодействии между собой, образуя часто весьма прочные связи, принципиально ничем не отличающиеся от таковых в соединениях первого порядка. Вместо старого учения о валентности, Вернер дает координационную теорию, вместо прежних структурных формул - координационные формулы (1)-(5), в которых, как, например, для серной кислоты, 4 атома кислорода так же равномерно сгруппированы вокруг атома серы, как в платинохлористоводородной кислоте 6 атомов хлора вокруг атома платины:
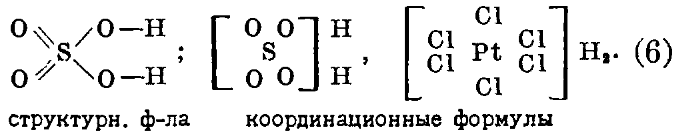
Количество атомов или групп, связанных с центральным атомом, или его координационное число, часто больше, чем его валентность в старом смысле; на этом и основана возможность образования соединений высшего порядка. Максимальное координационное число определяется для каждого атома из состава соответствующих его соединений, лучше всего - из аммиакатов . Исследования показали, что оно не зависит от характера групп, связанных с центральным атомом, и в большинстве случаев равняется 6. Важнейшими исключениями являются углерод и азот с координационным числом 4.
Учение Вернера не касается одной важной проблемы, сущность которой лучше всего пояснить на следующем произвольно выбранном примере. Если в хлороплатинате калия все 6 атомов одинаково связаны с атомом Pt [формула (5)], то почему не существует хлорида платины состояния PtCl 6 ? Действительно, высший хлорид платины, производным которого является хлороплатинат, будет PtCl 4 . То же самое относится и ко всем другим комплексам. Спрашивается, почему платина в комплексе все же шестивалентна. Вернер пытается обойти эту трудность, различая главные и побочные валентности. Так, в соединении первого порядка 4 Сl связаны главными валентностями с Pt. При присоединении же хлористого калия дальнейшие 2 Сl связываются побочными валентностями:
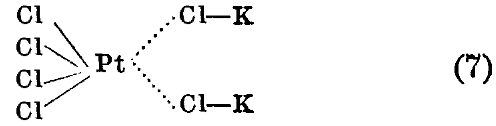
Вернер сам, однако, подчеркивает, что после того как побочные валентности привели уже к связи между соединяющимися атомами, различие между побочными и главными валентностями исчезает, и сродство равномерно распределяется между всеми атомами или группами. Такое различие между главной и побочной валентностями, по которому последняя либо не действует, т. е. не существует, либо действует, а тогда ни в чем не отличается от главной валентности, нельзя признать удовлетворительным. Как мы увидим ниже, новейшая теория весьма наглядно объясняет и это явление. Громадное значение исследований Вернера заключается в том, что они подготовили почву, на которой выросла современная теория, основанная на теории строения атома, предложенной Бором и Резерфордом (Rutherford).
Проблема внутреннего строения химического соединений сводится, в первую очередь, к тесно связанным между собой вопросам о природе химических сил и о сущности числовых значений валентности. Совершенно очевидно, что рациональная теория сродства немыслима без определенного представления о строении носителя этих свойств - атома. После того как Гельмгольц в 1881 г. пришел к выводу об атомистичности электричества, исследования катодных и каналовых лучей, а также и оптических свойств различных веществ показали, что элементарные частицы электричества - электроны - входят в состав атомов материи. Вскоре возникло предположение о тесной зависимости между числовым значением валентности и соответствующим числом слабо связанных электронов. К такому взгляду пришел Друде на основании исследования дисперсии и Дж. Дж. Томсон. Названные физики, независимо друг от друга, уже в 1904 г. высказали взгляд, согласно которому при образовании бинарного соединения из элементов (например, NaCl) один вид атомов отдает электроны (валентные электроны), а другой присоединяет их. Дж. Дж. Томсон, кроме того, указал на то, что образовавшиеся при этом ионы должны обладать особенно устойчивым расположением электронов. Построение Резерфордом и Бором новой модели атома (в 1913 г.) позволило затем (в 1916 г.) Льюису и, в особенности, Косселю сделать дальнейший важный шаг по пути к выяснению природы сродства и валентности. Основываясь на взглядах Томсона и Друде и на модели атома Бора и опираясь на большой фактический материал, систематизированный Вернером и Абеггом в периодической системе, Коссель с помощью законов электростатики воскресил дуалистические воззрения Берцелиуса и развил теорию полярных соединений, сумевшую дать единое объяснение множеству непонятных до тех пор фактов.
Коссель исходит из следующих представлений. Атом построен из положительно заряженного ядра и электронной оболочки; в поле атома поэтому не может быть места для иных сил, кроме электрических. Вопрос лишь в том, являются ли силы, действующие между составными частями атома, чисто электростатическими или играют роль также действия движущихся зарядов (электродинамические силы). Прежде всего Коссель останавливается на применимости закона Кулона для атомных измерений. Теория спектров Бора и опыты Резерфорда над рассеянием α-лучей действительно указывают на процессы в атомах, при которых заряды притягиваются обратно пропорционально квадрату расстояния. Отсюда непосредственно вытекает важный вывод для понимания химических сил. Если при взаимодействии между частями атомов можно пользоваться обычными представлениями об электрическом силовом поле, то это означает, что каждый заряд действует на каждый другой заряд. Силы между ближайшими зарядами будут, правда, особенно велики, но всякий из них должен действовать также и на более отдаленные заряды. Иными словами, теория поля исключает существование отдельных направленных сил . Коссель ограничивается рассмотрением простейшего случая возникновения полярных молекул и различает две стадии: 1) образование ионов и 2) соединение готовых ионов. Первая стадия связывается с стремлением атомов получить устойчивую электронную оболочку ближайшего благородного газа. Так, например, калий при взаимодействии с хлором теряет один электрон, а хлор приобретает его, в результате чего получаются ионы калия и хлора, обладающие оба таким же числом электронов, как и аргон. Во второй стадии речь идет о притяжении ионов, которые рассматриваются как заряженные шары, причем заряд сосредоточен в центре шара. Слиянию зарядов препятствуют электронные оболочки, действующие отталкивающим образом, благодаря чему поверхность ионов непроницаема. Введением столь простых представлений и применением законов электростатики Косселю удается объяснить такие различные химические явления, как образование комплексных соединений, диссоциация, кислотный и щелочной характер соединений и пр. Если имеем два иона, то работа удаления их друг от друга в бесконечность определяется выражением:
где ε - диэлектрическая постоянная среды, е 1 и е 2 - заряды ионов, r 1 и r 2 - радиусы ионов. При удалении иона из молекулы, состоящей из большего числа частиц, нужно принимать во внимание притяжение и отталкивание его от всех остающихся ионов, что ведет к сумме выражений, аналогичных формуле (8). Получаемый порядок величины для А действительно соответствует обычным теплотам реакции. Простой расчет, далее, показывает, почему, например, молекула NaCl, благодаря тепловому движению в водном растворе, диссоциирует на ионы, а в газообразном состоянии - нет (влияние диэлектрической постоянной среды). Весьма наглядно объясняется образование комплексных соединений. Возьмем, например, раствор PtCl 4 , который содержит ион Рt ∙∙∙∙ . При прибавлении КСl образуется анион (PtCl 6)". Благодаря своему высокому положительному заряду ион платины притягивает к себе еще два чужих иона хлора, причем этот процесс протекает с выигрышем энергии. При разряде же иона (PtCl 6)" на аноде, два электрона отдаются, два атома хлора теряют заряды и отпадают от комплекса; на аноде выделяется хлор. С утратой заряда исчезают и связывающие силы . Косселю также впервые удалось связать кислотный и щелочной характер химических соединений со строением молекул. В ряде: NaOH, Mg(OH) 2 , Аl(ОН) 3 , Si(OH) 4 , РО(ОН) 3 , SO 2 (OH) 2 , СlO 3 (ОН) первый член - сильное основание, второй - слабое основание, третий - амфотерное соединение, а дальнейшие соединения представляют собой кислоты возрастающей силы (строение этих соединений показано на приложенной фиг.).
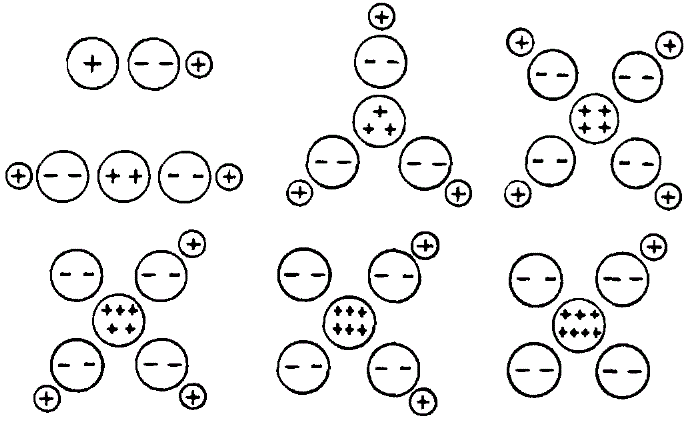
Отщепление группы ОН", являющейся носителем щелочного характера, при движении слева направо происходит все труднее, благодаря тому, что возрастающий положительный заряд центрального атома все сильнее и сильнее удерживает О". Отщепление же иона Н ∙ по мере перехода слева направо в приведенном ряде все более и более облегчается вследствие возрастающего отталкивания со стороны положительного центрального атома. Приближенный расчет показывает, что для средних представителей ряда работы отщепления ОН" и Н ∙ , примерно, равны. Здесь и наблюдается переход от щелочного характера химического соединения к кислотному. Простое объяснение получает и правило Абегга (см. выше). Число электронов, которое атом должен отдать, чтобы получить группировку электронов, подобную группировке благородного газа с меньшим атомным номером, определяет его положительную валентность; число же электронов, которое он должен присоединить, чтобы получить электронную группировку благородного газа с большим атомным номером, определяет его отрицательную валентность. Так как в первых периодах разница между числом электронов в атомах двух следующих друг за другом благородных газов равна 8, то отсюда ясно, почему сумма положительной и отрицательной валентностей во многих случаях равна 8. Приведенные немногие примеры достаточно ясно показывают плодотворность новой точки зрения. Преимущества такого воззрения, по сравнению с попыткой Берцелиуса рассматривать химические силы как электростатические, можно отметить в двух отношениях: 1) в описанной теории делается ограничение на случай строго полярных соединений, определяемых при помощи периодической системы; 2) в ней вводится понятие об объеме ионов, о котором во времена Берцелиуса, 100 лет тому назад, знали столь же мало, как о периодической системе. Представление об ионах, как о заряженных твердых сферах, разумеется, - только предельный случай, который может служить исходной точкой для грубого приближения; из статей Косселя, однако, явствует, что он отдает себе отчет в этом обстоятельстве.
Дальнейшим количественным развитием воззрений Косселя мы обязаны Борну. После открытия Лауе и работ обоих Бреггов Дебай и Шерер на примере фтористого лития (LiF) показали, что кристаллы щелочно-галоидных солей построены из ионов, обладают ионной решеткой . Прочность таких кристаллов обусловливается теми же силами, что и прочность молекул. Исходя из этого, Борн не только вычисляет ряд оптических и механических свойств кристаллов, но и дает количественную теорию полярных соединений. В этой теории, поставившей себе целью вычислить энергию образования солей из атомных констант элементов, большую роль играет новая термохимическая величина, введенная Борном, - энергия решетки U. Энергия эта равна работе, необходимой для разрушения кристаллической решетки на бесконечно удаленные друг от друга ионы. Равновесие ионов в кристалле достигается взаимодействием, с одной стороны, сил электростатического притяжения между противоположными зарядами и, с другой стороны, расталкивающей силой между электронными оболочками ионов. Рассматривая в первом приближении расталкивающую силу как центральную, убывающую по мере увеличения показателя степени расстояния r, Борн и Ланде выражают силу между двумя ионами К уравнением:
где а, b, n- константы (n> 1). Для кристаллов Борн и Ланде находят:
где N - число Авогадро, e 1 и е 2 - заряды ионов, α - потенциал Маделунга, зависящий от типа решетки, r - расстояние между ионами противоположного знака в решетке. Константа U вычисляется из сжимаемости и плотности кристалла. Чем меньше сжимаемость, тем, очевидно, больше n. Для ряда щелочно-галоидных солей упомянутые авторы находят n ≈ 9. Так. обр. второй член уравнения (10), соответствующий энергии расталкивающих сил (точно вычислить его пока невозможно), относительно невелик, и энергия решетки составляет примерно 8/9 от электростатической энергии. Поэтому числа, полученные Борном и Ланде, д. б. близки к истине. Если подставить числовые значения: N= 6,06∙10 23 , α = 13,94, е = 4,774∙10 -10 , n = 9, перечислить на калории и выразить rчерез V где V - молекулярный объем, равный молекулярный вес М/плотность = M/ d , то получается формула Борна, действительная для кристаллов типа NaCl:
В таблице приведены вычисленные таким путем значения энергии решетки для щелочно-галоидных солей.
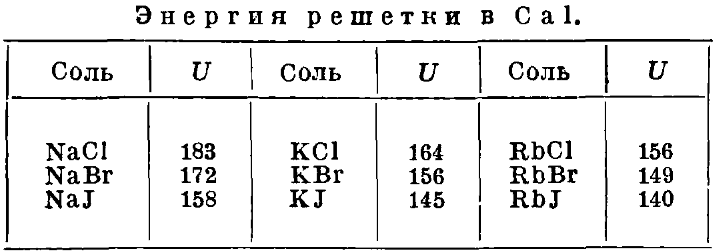
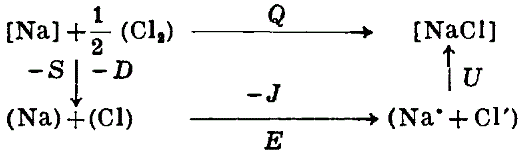
В цикле Борна образование соли из элементов мыслится двумя способами: 1) непосредственным соединением, причем выделяется теплота Q и 2) обходным путем, при котором образование, например, твердого хлористого натра из металлического натрия и газообразного хлора (Сl 2) распадается на следующие стадии: 1) сублимируется, причем затрачивается теплота сублимации - S; 2) от газообразных атомов натрия (Na) отрывается по одному электрону, на что расходуется энергия ионизации - J; 3) сообщая молекулам хлора энергию диссоциации D, их диссоциируют на атомы, которые присоединяют по одному электрону, выделяя энергию Е - сродство к электрону; 4) наконец, газообразные ионы (Na ∙ ) и (Сl ∙ ) образуют кристалл , причем выделяется энергия решетки U. Все значения относятся к 1 грамм-атому элементов или 1 грамм-молекуле соли. Для теплоты образования получаем:
Отсюда, в согласии с теорией: U NaC l = 180 Cal. Однако значения для сродства галоидов к электрону, которыми мы располагаем в настоящее время, ненадежны. Более достоверные (но менее доказательные) результаты дает сравнение относительных значений энергии решетки. Для двух солей с одним и тем же анионом мы имеем, например:
Здесь справа - все величины, измеренные на опыте. Совпадение между теоретическими значениями и экспериментальными оказалось удовлетворительным.
На интересное применение теории Борна указали Гримм и Герцфельд. Основываясь на круговом процессе, они подошли к вопросу о валентности металлов и химической инертности благородных газов. Авторы задались вопросом, почему нет таких соединений, как NeCl, NaCl 2 , MgCl 3 , АlСl 4 . В соответствии с опытом вычисление показало, что теплоты образования подобных соединений, являющиеся приблизительной мерой сродства, имеют сильно отрицательные значения. Поэтому такие соединения не могут существовать. Объясняется это тем, что движущие силы химической реакции - энергия решетки и сродство к электрону (если оно положительно), - обусловливающие в круговом процессе положительный баланс энергии, в данном случае недостаточны для преодоления больших энергий, связанных с отрывом электрона от оболочки благородного газа. Из возможных соединений: MgCl, MgCl 2 , MgCl 3 или АlСl, АlСl 2 , АlСl 3 , АlСl 4 наиболее устойчивыми оказываются, в согласии с опытом, MgCl 2 и АlСl 3 .
В основе всех приведенных до сих пор воззрений лежит допущение, что в молекуле или в кристаллах ионы остаются неизменными. Однако уже Коссель указал, что электростатическое поле катиона должно производить на анион деформирующее действие в том смысле, что катион перетягивает к себе электронную оболочку аниона. Различные степени этого смещения позволяют объяснить переходные формы между молекулами с идеальной ионной связью, с одной стороны, и неполярными соединениями, с другой стороны. Габер отметил важное следствие, вытекающее из способности ионов деформироваться; он показал, что энергия, освобождающаяся при соединении водородного иона с галоидным ионом в молекулу галоидоводорода, многим больше (приблизительно на 100 Cal), чем можно было бы ожидать, принимая недеформированные ионы. Габер толковал столь большой энергетический эффект в смысле смещения ядра галоидного иона по отношению к его оболочке, а Рейс на этом основании поставил особые свойства водородных соединений в связь с сильным деформирующим действием водородного иона. Независимо от этого Борн пришел к убеждению, что для объяснения физических свойств (остаточные лучи, упругие и пьезоэлектрические константы) некоторых кристаллов нужно принять во внимание деформируемость ионов. Самое наглядное указание на взаимную деформацию ионов в солеобразных соединениях дано Мейзенгеймером (в 1921 г.), который объяснил цвет некоторых солей искажением (деформацией) ионов. Т. к. многие соли свинца и многие иодиды бесцветны, то свободные ионы свинца и йода нужно считать бесцветными. А из того, что йодистый свинец интенсивно желтого цвета, нужно заключить, что в этом соединении электронная оболочка (по крайней мере одного из ионов) испытала изменение под влиянием другого иона. Таких примеров можно привести множество. Указания на деформацию ионов можно найти у Лангмюра и Льюиса. Наконец Дебай сделал попытку свести ван-дер-ваальсовские силы к взаимной поляризации молекул, причем электрическому моменту молекул приписывается поляризующее действие на соседние молекулы. В последнее время влияние деформации ионов и молекул на свойства химических соединений (мерой которой может служить молярная рефракция) подвергнуто систематическому изучению. Фаянс сумел объяснить целый ряд свойств солеобразных соединений (окраска, растворимость, проводимость в твердом состоянии, фотоэлектрическая электропроводность) с точки зрения деформации электронных оболочек и установил между ними определенные зависимости. Борн и Гейзенберг подвергли затем (в 1924 году) проблему деформации ионов количественному изучению. Они вычислили для простейших молекул энергию V, освобождающуюся при соединении газообразных ионов в молекулы пара. При этом они применили те же принципы, которые Борн ввел для вычисления энергии решетки U, с тем различием, что в молекуле принимается во внимание односторонняя поляризация ионов, связанная с значительным энергетическим эффектом. Сравнение вычисленных значений с экспериментальными с помощью уравнения V = U-S (где S - теплота сублимации соли) дало приблизительное совпадение.
Если в области полярных соединений результаты, достигнутые новой теорией, несомненно замечательны, то нельзя того же сказать о гомеополярных соединениях. Здесь теория находится еще в зачатке. Достаточно отметить, что строение простейшей молекулы, водорода, еще совершенно неизвестно, не говоря уже о более сложных, например, органических, молекулах. Причина этого в том, что нам неизвестны квантовые законы системы, состоящей из ядра и хотя бы двух электронов, например атома гелия. Атомы же гомеополярных молекул, по-видимому, тем и отличаются, что, в отличие от атомов полярных молекул, они имеют общие электроны. Под гомеополярными, или неполярными, веществами мы вообще подразумеваем такие, в которых нет указаний на существование противоположно заряженных атомов. Мы можем их подразделить на три большие группы, обладающие весьма, различными свойствами. 1) Молекулы, построенные из атомов металлоидов . Сюда относятся, например, Н 2 , N 2 , О 2 , F 2 , СО, NO, JCl, СН 3 ∙СН 3 и почти все органические соединения. Силы, обусловившие сцепление молекул и атомов, здесь различны между собой. Вещества эти относительно летучи; как правило, не проводят электрического тока и в твердом состоянии образуют молекулярные решетки. 2) Алмазоподобные вещества с тетраэдрической связью , например, [С], , , , и некоторые соединения этих элементов с соседними в периодической системе элементами, например, , [АlN]. Вещества эти нелетучи и показывают атомную решетку. Часть их не проводит электрического тока. 3) Металлы и интерметаллические соединения , например, , [Сu], , , и различные сплавы. Здесь, по-видимому, силы, обусловливающие сцепление молекул и атомов, одни и те же. Вещества эти обычно трудно летучи, образуют атомные решетки и хорошо проводят электрический ток. О механизме гомеополярной связи мы практически ничего не знаем. Ни одна из предложенных теорий не дала сколько-нибудь удовлетворительных результатов.