Чему равна относительная атомная масса углерода. Введение в общую химию
К изучению первой темы курса химии следует подходить как к освоению алфавита и таблицы умножения: в ней все определения и весь понятийный аппарат должны быть усвоены досконально, определения поняты и заучены. Свобода владения этим материалом на уровне компетенций поможет в последующих темах легко ориентироваться в новых терминах и закономерностях.
Основными физическими величинами Международной системы измерений (СИ) являются:
метр (м) – единица измерения длины;
килограмм (кг) – единица измерения массы;
секунда (с) – единица измерения времени;
ампер (А) – единица измерения силы электрического тока;
кельвин (К) – единица измерения термодинамической температуры;
кандела (Кд) – единица измерения силы света;
моль (моль) – единица измерения количества вещества.
В систему измерений СИ введено некоторое число производных величин: джоуль (Дж) – единица измерения работы, энергии и количества теплоты; паскаль (Па) – единица измерения давления и механического напряжения.
В расчетах широко применяются и внесистемные единицы измерений. К ним относятся:
атомная единица массы (а. е. м.) – единица массы в атомной физике и квантовой химии;
электронвольт (эВ) – единица энергии в атомной физике и квантовой химии;
литр (л) – единица объема и вместимости;
градус Цельсия (0 С) - единица температуры;
тонна (т) – единица массы;
гектар (га) – единица площади;
минута, час, сутки – единицы времени.
Единицу, в целое число раз бóльшую системной или внесистемной, называют кратной единицей (например, киломоль (кмоль) - в 1000 раз больше моля), а в целое число раз меньшую – дольной единицей (например, миллиметр (мм) – в 1000 раз меньше метра).
К наиболее распространенным количественным величинам, используемым в химических расчетах, относят массу вещества, но в химии применяется несколько различных понятий массы: абсолютная и относительная атомная (молекулярная) масса; массовое число; количество вещества, моль; молярная масса; количество вещества эквивалента и молярная масса эквивалента. Напомним эти химические понятия и расчетные формулы, в которых они используются.
Абсолютная атомная (молекулярная) масса (обозначается ) – истинная физическая масса атома химического элемента или молекулы химического соединения, выраженная в физических единицах массы.
Например, = 1кг;= 1,67·1кг;(О) = 2,66·1кг; кг.
Относительная атомная (молекулярная) масса (обозначается) – условная безразмерная нефизическая величина, показывающая, во сколько раз физическая масса атома или молекулы больше одной атомной единицы массы (1 а. е. м.), равнойчасти физической массы атома углерода изотопа:
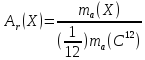 ;
=
(1)
;
=
(1)
В формулах (1) использованы следующие
обозначения:
- относительная атомная масса атома
химического элемента
;(Y
)
– относительная молекулярная масса
молекулы химического соединенияY
;(X
)
и(Y
)
– абсолютные физические массы атомаХ
и молекулы веществаY
,
выраженные в единицах массы (кг, г);)
– абсолютная физическая масса атома
углерода изотопа.
Двенадцатая часть этой величины или 1
а. е. м.![]() =
кг.
=
кг.
Например, рассчитанная по этой формуле
относительная атомная масса одного
атома кислорода равна (O
) =
![]() 16;
а относительная молекулярная масса
молекулы кислорода равна)
16;
а относительная молекулярная масса
молекулы кислорода равна) 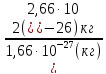 32.
32.
Как видим, относительная молекулярная масса веществачисленно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы этого вещества. Она легко вычисляется по формуле вещества.
Заметим, что в Периодической системе химических элементов Д.И. Менделеева приведены средние взвешенные значения относительных атомных масс всех устойчивых изотопов известных химических элементов.
Например, относительная молекулярная масса вещества железа (3) сульфата будет определяться как сумма произведений относительных атомных масс составляющих молекулу этого соединения химических элементов на их количество, отображенное в формуле соответствующими индексами:
] 2(Fe ) 3(S ) 3·4(O ).
Значения относительных атомных масс элементов находим в Периодической таблице, произведём расчет и получим величину относительной молекулярной массы соли:] 400.
Массовое число (обозначаетсяА) - физическая величина, отражающая массу ядра изотопа атома любого химического элемента, определяемая, как сумма произведений количества протонов () и нейтронов (), входящих в состав ядра, на их относительную массу(p) и(n). Массовое число выражается в атомных единицах массы (а. е. м.).
Физические массы протона и нейтрона равны между собой и равны физической массе 1 а. е. м.: (p)(n) г, а(p) (n) 1 а. е. м. Отсюда:
А = (p ) + (n ) (а. е. м.); А = + . (2)
Из определения можно сделать вывод о том, что массовое число всегда будет величиной целой и положительной.
Количество вещества, моль (обозначается латинской буквойn ) – это реальная физическая величина, показывающая определенное количество вещества любой химической системы, содержащее столько ее структурных элементов, сколько атомов содержится в 0,012 кг (12 г) химического вещества углерода, состоящего из атомов изотопа.
При применении величины моля структурные элементы химической системы должны быть определены, и они могут состоять как из реальных структурных единиц (например, отдельных атомов, молекул, ионов, электронов, нуклонов, или из ансамблей атомов, молекул, ионов), так и из условных структурных элементов (например, молекулы перманганата калияв окислительно-восстановительном процессе).
Количество структурных элементов (атомов) в одном моле атомов углерода изотопа легко рассчитать по формуле:
)![]() .
.
Полученная величина имеет постоянное значение и показывает число структурных элементов в любом веществе количеством 1 моль. Эта величина известна как число Авогадро . С другой стороны, отношение числа структурных элементов в любой системе (N) к количеству вещества этой системы (n ) также является постоянной величиной. Она относится к физическим константам, имеющим размерность, и называетсяпостоянной Авогадро (обозначается). Из определения следует, что = = . Физической смысл этой величины состоит в том, что в одном моле любого вещества всегда содержитсяструктурных элементов этого вещества.
При расчетах следует указывать, какие структурные элементы в них участвуют. Например, 1 моль атомов кислорода n (О )1 моль, или 1 моль молекул кислородаn ()1 моль; 1 моль атомов водородаn (Н )1 моль, или 1 моль катионов водородаn ()1 моль, или 1 моль протонов в ядрахn (р)1 моль, и т. д.
В общем случае для определения количества вещества любой химической системы можно использовать следующую расчетную формулу:
n = (моль) , (3)
где n – количество вещества структурных элементов химической системы (моль);N –количество структурных элементовэтой системы;– постоянная Авогадро ().
Молярная масса (М ) – физическая масса одного моля вещества любой химической системы, выраженная в единицах массы (г/моль; кг/моль; кг/кмоль). Из самого определения молярной массы следует ее расчетная формула:
М = ,(4)
где М – молярная масса вещества или физическая масса 1 моля химического вещества (г/моль или кг/кмоль);m – физическая масса определенной доли этого вещества (г или кг);n – количество вещества структурных элементов в указанной доле (моль или кмоль). Сравнивая формулы (3) и (4), получим еще одну расчетную формулу:
М = m). (5)
Для любого атома как структурного элемента химического вещества его молярная масса численно совпадает с величиной относительной атомной массы химического элемента Периодической таблицы. Соответственно, молярная масса химического соединения численно совпадает с относительной молекулярной массой этого соединения, рассчитанной по его химической формуле. Однако физический смысл понятий «молярная масса вещества» и «относительная атомная (молекулярная) масса» совершенно разный.
Например, для химического вещества
диоксида углерода число 44 - относительная
масса молекулы
(![]() 44),
показывающая, что эта молекула в 44 раза
тяжелее одной а. е. м. А величина 44 г/моль
– это физическая масса порции газа,
состоящей измолекул данного газа, т.е. молярная масса.
44),
показывающая, что эта молекула в 44 раза
тяжелее одной а. е. м. А величина 44 г/моль
– это физическая масса порции газа,
состоящей измолекул данного газа, т.е. молярная масса.
Закон Авогадро : в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Из закона вытекают два следствия.
Следствие 1 : Одинаковое число молекул разных газов при одинаковых условиях занимают одинаковый объем.
Для одного моля вещества, в котором содержится молекул, этот объем называется молярным, и если условия, при которых находится газ, нормальные (273 К и Па), то молярный объем равен 22,4 л. Этот объем был назван молярным объемом любого газа при нормальных условияхилиобъемной постоянной Авогадро: = 22,4 л/моль . Из сказанного следует, что количество вещества любого газообразного объекта (n ) можно определить, если известен занимаемый им при нормальных условиях объем (), или объем (V ), занимаемый при произвольных условиях:
n = ();n = ().(6)
Следствие 2 : Отношение масс равных объемов различных газов при одинаковых условиях есть величина постоянная, и называетсяотносительной плотностью одного газа по другому газу:
приV 1 = V 2 = ( Р,Т = (7)
Здесь: – относительная плотность газа 1 по газу 2 или величина, показывающая во сколько раз первый газ легче или тяжелее второго газа, если они находятся при одинаковых условиях (Р; Т );и– физические массы равных объемов газов 1 и 2;и– молярные массы этих газов.
Заметим при этом, что относительную плотность газовD нельзя путать с плотностью газаρ , обозначающую, как и в случае жидкостей, отношение физической массы газа m к его объемуV :
ρ = . (8)
Плотность неизвестного газа относительно известного легко определить эмпирическим путем, и затем, зная молярную массу известного газа, рассчитать молярную массу неизвестного газа:
= DM . (9)
С помощью уравнения состояния идеального газа или уравнения Менделеева-Клапейрона можно произвести любые расчеты для газовых систем при условиях отличных от нормальных:
PV = RT , (10)
где Р – давление газа, Па;V – его объем,;Т – температура, К;m – физическая масса газа, г;М – его молярная масса, г/моль;R – коэффициент пропорциональности, называемыйуниверсальной газовой постоянной Ридберга , равныйR 8,314.
Вместе с тем, объемную постоянную Авогадро можно применить лишь в том случае, если газ находится при нормальных условиях (, ). Приведение газа к нормальным условиям обеспечиваетобъединенный газовый закон Шарля :
m = m ,(11)
где Р, V иТ – параметры состояния газа массой m при любых условиях;, , – параметры состояния этого же газа массой m при нормальных условиях, т.е. при температуре 273 К и давлении Па.
Для произвольных условий молярный объем газа определяется по формуле:
V m = и тогдаρ = . (12)
Химический эквивалент (обозначаетсяЭ ) – реальная или условная частица химического вещества, вступающая во взаимодействие прямым или косвенным образом с одним ионом водорода (в кислотно-основных или ионообменных реакциях) или с одним электроном ē (в окислительно-восстановительных реакциях).
Эквивалент – безразмерная величина, состав которой выражают с помощью химических формул и символов. Его численное значение зависит от конкретной реакции cучастием данного химического вещества. Рассмотрим несколько примеров.
В реакцию с одной молекулой натрия гидроксида
вступил лишь один ион водорода от молекулы серной кислоты. Следовательно, эквивалент натрия гидроксида и эквивалент серной кислоты будут равны одной молекуле щелочи и одной молекуле кислоты. Аналогично рассуждаем и по отношению к продуктам этой реакции: эквивалент натрия гидросульфата и эквивалент воды также будут равны одной молекуле соли и одной молекуле воды, соответственно: Э ;Э () ;Э () ;Э (O ) O .
Зато в реакции с двумя молекулами щелочи по уравнению
участвуют два иона водорода от одной молекулы серной кислоты, следовательно эквивалентом серной кислоты, также как и эквивалентом соли натрия сульфата, является половина каждой молекулы (Э ();Э ()), в то время как эквивалентом натрия гидроксида и воды остается одна молекула каждого из этих веществ (Э ();Э ()).
По аналогии, эквивалентом фосфорной кислоты может быть целая молекула (Э ()), ее половина (Э ()) или ее треть (Э ()) в зависимости от условий протекания реакции с участием фосфорной кислоты.
У ванадия (4) хлорида величина эквивалента может иметь четыре различных значения согласно следующим уравнениям реакций гидролиза этой соли:
О ;Э () ;
2О 2;Э ();
3О 3;Э ();
4О 4;Э ().
Из этих уравнений легко также определить
и эквиваленты основных солей, образующихся
в процессе гидролиза
:Э
();Э
()![]() ;Э
(
;Э
(![]() ;Э
(.
;Э
(.
В то же время эквивалент воды и соляной кислоты во всех реакциях постоянен и равен одной молекуле каждого из этих веществ (Э (О )О ;Э ()).
В окислительно-восстановительном процессе:
для восстановления одной молекулы кислорода до состояния воды понадобилось 4ē (2), для окисления одной молекулы железа (2) хлорида - 1ē (). Соответственно, при образовании одной молекулы воды использованы 2ē, а одной молекулы хлорида железа (3) – отдан 1ē. Исходя из этого устанавливаем, что в окислительно-восстановительном процессеЭ ();Э ();Э (О )О ;Э (). Анионы в окислительно-восстановительном процессе не участвовали, катионы - также, они лишь создавали благоприятную кислотную среду, поэтому в данной конкретной реакции эквивалент соляной кислотыЭ ()0.
Приведенные примеры доказывают, что эквивалент любого химического вещества - величина переменная и зависит от условий химической реакции, в которой это вещество участвует. Понятие эквивалента химического объекта без указания конкретного химического процесса неприменимо.
Число, обозначающее долю реальной частицы, эквивалентную (равнозначную) одному иону или одному электрону ē, называютфактором эквивалентности (f э ).
Следовательно, f э ().f э ().f э (О )
f э ().f э ().f э ().
Легко заметить, что фактор эквивалентности обратно пропорционален валентности, проявляемой атомом или молекулой в химической реакции, т.е. f э .
Количество вещества эквивалентов (обозначается, выражается в моль ) - наименьшее количество вещества химической системы, взаимодействующее прямым или косвенным образом с одним молем атомов или ионов водорода (1 мольН или 1 моль) или с одним молем электронов (1 моль ē) в соответствующих химических процессах.
Из этого определения следует, что в одном моле эквивалентов любого вещества содержится эквивалентов этого вещества. С другой стороны, если известны факторы эквивалентности химических реагентов, участвующих в конкретном химическом процессе, то количество эквивалентов каждого из участников этого процесса будет определяться по формулам:
= n , или ==(13)
Физическую массу одного моля эквивалентов вещества называют молярной массой эквивалентов этого вещества (обозначается, выражается в г/моль ).
(простого в-ва) М (простого в-ва) = .(14)
(сложного
в-ва) М
(сложного
в-ва) =
![]() , (15)
, (15)
где B– валентность атома простого вещества или функциональной группы сложного вещества,N– число атомов простого вещества или функциональных групп сложного вещества, участвующих в процессе.
Заметим, что в кислотах функциональной группой является ион , в основаниях – ион, в солях – ион металла. Следовательно,();(), но);)или));).
Для вычисления объема, занимаемого одним молем эквивалентов газообразного вещества, используется аналогичная формула:
или . (16)
В формуле (16) – молярный объем газа, или объем, который занимает 1 моль любого газа при нормальных условиях, он равен, как мы помним, 22,4 л/моль.
Отсюда следует, что один моль эквивалентов водорода занимает объем )= 11,2 л; один моль эквивалентов кислорода занимает объем)= 5,6 л; один моль эквивалентов диоксида углеродазанимает объем)11,2 л.
Согласно закону эквивалентов И. Рихтера вещества взаимодействуют между собой в количествах, пропорциональных их эквивалентам. Следовательно, для реакции, которую схематично можно изобразить в виде, математическое выражение закона эквивалентов запишется так:
= .(17)
В уравнении (17) m (A ) иm (B )– физические массы реагентов, вступивших в реакцию.
Закон эквивалентов справедлив и по отношению к продуктам реакции, поэтому его математическое выражение может быть представлено и в ином виде, в зависимости от той задачи, которую необходимо решить:
= ; (18)
Выражения (17) и (18) можно записать и в ином виде:
= =, (19)
из чего следует, что количества вещества эквивалентов (n э ) всех реагентов реакции равны между собой:(A ) = (B ) = (AB ). (20)
Закон эквивалентов позволяет использовать и еще одну расчетную формулу определения молярной массы эквивалентов сложного вещества как суммы молярных масс эквивалентов составляющих это вещество атомов химических элементов. Если общая формула сложного вещества , то его молярная масса эквивалента равна
) = (А ) + (В ) + (С ). (21)
Для веществ, взаимодействующих в растворах, закон эквивалентов удобно представить в виде · = · ,(22)
где и– молярные концентрации эквивалентов растворов (1) и (2), выраженные в моль/л;и– объемы взаимодействующих растворов, л.
К изучению первой темы курса химии следует подходить как к освоению алфавита и таблицы умножения: в ней все определения и весь понятийный аппарат должны быть усвоены досконально, определения поняты и заучены. Свобода владения этим материалом на уровне компетенций поможет в последующих темах легко ориентироваться в новых терминах и закономерностях.
Основными физическими величинами Международной системы измерений (СИ) являются:
метр (м) – единица измерения длины;
килограмм (кг) – единица измерения массы;
секунда (с) – единица измерения времени;
ампер (А) – единица измерения силы электрического тока;
кельвин (К) – единица измерения термодинамической температуры;
кандела (Кд) – единица измерения силы света;
моль (моль) – единица измерения количества вещества.
В систему измерений СИ введено некоторое число производных величин: джоуль (Дж) – единица измерения работы, энергии и количества теплоты; паскаль (Па) – единица измерения давления и механического напряжения.
В расчетах широко применяются и внесистемные единицы измерений. К ним относятся:
атомная единица массы (а. е. м.) – единица массы в атомной физике и квантовой химии;
электронвольт (эВ) – единица энергии в атомной физике и квантовой химии;
литр (л) – единица объема и вместимости;
градус Цельсия (0 С) - единица температуры;
тонна (т) – единица массы;
гектар (га) – единица площади;
минута, час, сутки – единицы времени.
Единицу, в целое число раз бóльшую системной или внесистемной, называют кратной единицей (например, киломоль (кмоль) - в 1000 раз больше моля), а в целое число раз меньшую – дольной единицей (например, миллиметр (мм) – в 1000 раз меньше метра).
К наиболее распространенным количественным величинам, используемым в химических расчетах, относят массу вещества, но в химии применяется несколько различных понятий массы: абсолютная и относительная атомная (молекулярная) масса; массовое число; количество вещества, моль; молярная масса; количество вещества эквивалента и молярная масса эквивалента. Напомним эти химические понятия и расчетные формулы, в которых они используются.
Абсолютная атомная (молекулярная) масса (обозначается ) – истинная физическая масса атома химического элемента или молекулы химического соединения, выраженная в физических единицах массы.
Например, = 1кг;= 1,67·1кг;(О) = 2,66·1кг; кг.
Относительная атомная (молекулярная) масса (обозначается) – условная безразмерная нефизическая величина, показывающая, во сколько раз физическая масса атома или молекулы больше одной атомной единицы массы (1 а. е. м.), равнойчасти физической массы атома углерода изотопа:
; = (1)
В формулах (1) использованы следующие обозначения: - относительная атомная масса атома химического элемента ;(Y ) – относительная молекулярная масса молекулы химического соединенияY ;(X ) и(Y ) – абсолютные физические массы атомаХ и молекулы веществаY , выраженные в единицах массы (кг, г);) – абсолютная физическая масса атома углерода изотопа. Двенадцатая часть этой величины или 1 а. е. м.= кг.
Например, рассчитанная по этой формуле относительная атомная масса одного атома кислорода равна (O ) = 16; а относительная молекулярная масса молекулы кислорода равна) 32.
Как видим, относительная молекулярная масса веществачисленно равна сумме относительных атомных масс всех атомов, входящих в состав молекулы этого вещества. Она легко вычисляется по формуле вещества.
Заметим, что в Периодической системе химических элементов Д.И. Менделеева приведены средние взвешенные значения относительных атомных масс всех устойчивых изотопов известных химических элементов.
Например, относительная молекулярная масса вещества железа (3) сульфата будет определяться как сумма произведений относительных атомных масс составляющих молекулу этого соединения химических элементов на их количество, отображенное в формуле соответствующими индексами:
] 2(Fe ) 3(S ) 3·4(O ).
|
В результате изучения данной темы вы узнаете:
В результате изучения данной темы вы научитесь:
Учебные вопросы: |
2.1. Атомно-молекулярное учение
Многие вещества имеют атомное строение , т.е. состоят из атомов. Это, в первую очередь, металлы и их сплавы, а также соединения внедрения – карбиды, нитриды и др. В карбидах и нитридах атомы углерода или азота занимают пустоты в кристаллической решетке металла.
Другие вещества состоят из ионов, т.е. имеют ионное строение . Примерами таких веществ являются оксид кальция (Ca 2+ O 2-), хлорид калия(K + Cl -) и др.
Большинство же веществ имеют молекулярное строение . К этому типу веществ относятся почти все органические соединения, вода (Н 2 О), углекислый газ (СО 2), водород (Н 2), хлор (С1 2), кислород (О 2) и т.д.
Важную роль в развитии атомно-молекулярного учения сыграли работы великого русского ученого М.В. Ломоносова. Основные положения этого учения:
1. Большинство известных в настоящее время веществ состоят из молекул. Молекула – наименьшая частица некоторых веществ (имеющих молекулярное строение), которая имеет химические свойства и состав данного вещества. Таким образом, химические свойства молекулы определяются ее составом и химическим строением. Следует подчеркнуть, что только для веществ, имеющих молекулярное строение химические свойства молекул и веществ одинаковы. В то же время имеются некоторые вещества - полимеры, состав которых не соответствует составу молекул из которых они образованы (например, этилен и полиэтилен).
2. Молекулы состоят из атомов. Атом – электронейтральная динамическая система, состоящая из ядра, образованного протонами и нейтронами, и электронов .
3. Молекулы и атомы находятся в непрерывном движении. В частности, для входящих в состав молекул атомов и групп атомов характерно наличие поступательного, вращательного и колебательного движения.
4. При протекании химических реакций из одних веществ образуются другие вещества.
2.2. Химические элементы
Нет точных сведений, откуда произошло слово «элемент». По одной из версий, оно образуется при произношении букв латинского алфавита – l, m, n, t.
Химический элемент – совокупность атомов с одинаковым положительным зарядом ядра. Например, элемент «сера» включает атомы S, входящие в состав любых соединений (Na 2 SO 4 , SO 2 , H 2 S и т. д.)
Каждый элемент имеет свое название и свой символ, например, элементы магний - Mg, сера - S, водород - H и т. д. (см. периодическую таблицу).
В настоящее время известно 118 химических элементов. 101–й химический элемент назван менделевием (Md) в честь автора периодического закона Д.И. Менделеева. Название элемента с порядковым номером 104 - резерфордий (Rf), 105 - дубний (Db), 106 – сиборгий (Sg), 107 – борий (Bh), 108 – хассий (Hs), 109 – мейтнерий (Mt). Элемент с порядковым номером 110 назван дармштадтием , 111 - рентгением , 112 - коперницием .
23 сентября 2003 г на XVII Менделеевском съезде по общей и прикладной химии (г. Казань) ученые Объединенного института ядерных исследований (ОИЯИ) (г. Дубна) объявили о синтезе 115 и 113 элементов периодической системы. Для синтеза 115 элемента мишень, изготовленную из 95 элемента – америция, бомбардировали ионами редкого изотопа кальция-48, ускоренного до 1/10 скорости света. В результате было зарегистрирована картина распада 115 элемента: пять последовательных альфа-распадов общей продолжительностью около 20 секунд, в результате которых получился 105 элемент – дубний. Этот элемент “прожил” более 20 часов. Работа российских ученых подтвердила существование так называемого “острова стабильности” ранее неизвестных сверхтяжелых элементов, гипотеза о существовании которых была выдвинута еще в середине 1960-х годов. 114 и 116 элементы были синтезированы ранее в результате совместных исследований ОИЯИ и Ливерморской национальной лаборатории (США) и показали, что эти элементы живут в сотни и тысячи раз дольше, чем их более легкие предшественники (92 элемент – уран – живет около 1 миллиарда лет, то 112 элемент – только 0,00002 секунды).
24 октября 2012 года в Москве в Центральном доме ученых РАН состоялась торжественная церемония присвоения 114-му элементу имя "флеровий , а 116-му - "ливерморий ".
Одной из важнейших характеристик элементов является их распространенность в земной коре. Распространенность химических элементов обычно выражают в кларках (по имени американского геохимика Ф.У. Кларка, предложившего метод расчета химического состава земной коры). Массовый кларк элемента равен его массовой доле, т.е. отношению массы данного элемента к суммарной массе всех элементов, составляющих земную кору. Атомный кларк химического элемента характеризует долю атомов данного элемента в общем числе атомов всех элементов земной коры. Самым распространенным элементом является кислород – 42,7% массы земной коры, затем идет кремний – 27,6%, алюминий – 8,8% и т.д.
2.3. Простые и сложные вещества; аллотропия
Вещество – это любая совокупность атомов и молекул, находящаяся в определенном агрегатном состоянии. Химические вещества подразделяются на простые и сложные.
Простые вещества образованы из атомов одного элемента. Примерами простых веществ являются кислород O 2 , сера S 8 , железо Fe.
Сложные вещества, или химические соединения, образованы атомами различных элементов. Вода H 2 O, поваренная соль NaCl и углекислый газ СO 2 являются химическими соединениями.
Понятие «химический элемент» нельзя отождествлять с понятием «простое вещество». Например, кислород как простое вещество характеризуется определенными физическими и химическими свойствами. Кислород как химический элемент – не имеет физических свойств - вид атомов с зарядом ядра +8, которые могут входить в состав простых (O 2 , O 3) или сложных веществ (H 2 O, H 2 SO 4 , HCOOH и т.д.).
Явление, когда элементы образуют несколько простых веществ, различающихся строением, составом и свойствами, называется аллотропией , а соответствующие простые вещества – аллотропными видоизменениями или модификациями . Так, элемент углерод образует четыре аллотропные модификации – алмаз, графит, карбин и фуллерены, элемент кислород – две: кислород и озон, более десяти аллотропных модификаций образует фосфор.
2.4. Относительная атомная и относительная молекулярная масса
Значения масс атомов, выраженные в абсолютных единицах (г, кг) массы (абсолютные атомные массы m A), очень малы. Так, масса атома водорода составляет 1,66·10 -27 кг, углерода – 1,99·10 -26 кг. Чрезвычайно малыми оказываются и массы молекул (абсолютная масса молекулы обозначается m M), например, масса молекулы воды равна 2,99·10 -26 кг. Поэтому для удобства используют понятие об относительной массе атомов и молекул.
За единицу атомной массы принята атомная единица массы (а.е.м), равная 1/12 массы изотопа углерода 12 С:
1 а.е.м. = 1/12 m A (12 С) = 1,66· 10 -27 кг = 1,66· 10 -24 г.
Относительной атомной массой А r элемента называют отношение средней массы атома естественного изотопного состава элемента к 1/12 массы атома углерода 12 С.
Относительной молекулярной массой М r вещества называют отношение средней массы молекулы естественного изотопного состава вещества к 1/12 массы атома углерода 12 С. Относительная молекулярная масса равна сумме относительных атомных масс атомов, входящих в состав молекулы.
Относительные массы являются безразмерными величинами. Абсолютные и относительные атомные и молекулярные массы связаны соотношениями:
m A = A r · 1 а.е.м,
m M = M r · 1 а.е.м.
Если вещество не имеет молекулярного строения, то его молекулярная масса равна сумме относительных атомных масс атомов, которые составляют так называемую «формульную единицу» вещества, например:
CaSO 4 , Mn 3 C, KAl(SO 4) 2 · 12H 2 O, Cl.
2.5. Моль; молярная масса
За единицу количества вещества в Международной системе единиц (СИ) принят моль.
Моль – это количество вещества, содержащее столько структурных элементов (атомов, молекул, ионов, электронов, других частиц или их групп), сколько атомов углерода содержится в 0,012 кг (12 г) изотопа 12 С. При использовании понятия моль структурные элементы должны быть указаны, например, моль электронов. Моль был введен в Международную систему единиц (СИ) в качестве седьмой основной единицы в 1971 г. на XIV Генеральной конференции по мерам и весам.
Число атомов N A в 0,012 кг углерода можно вычислить, зная массу одного атома углерода:
N A = 0,012 кг/моль: 1,993· 10 -26 кг = 6,02· 10 23 моль -1 .
Величина N A называется постоянной Авогадро (другое название – число Авогадро), показывает число структурных элементов в 1 моль любого вещества и имеет размерность моль -1 .
Молярная масса М вещества – величина, равная отношению его массы m к количеству вещества n:
где m – масса в граммах, n – количество вещества в моль, М – молярная масса в г/моль. Таким образом, молярная масса вещества – это масса 1 моль вещества. Масса 1 моль воды, например, составляет 18 г, алюминия – 27 г, поваренной соли (хлорида натрия) – 58,5 г.
Численные значения М и М r равны, однако молярная масса имеет размерность г/моль или кг/моль, а относительная молекулярная масса безразмерна:
М = N A · m М (1 молекулы) = N A · M r · 1 а.е.м. = M r .
2.6. Химические знаки, формулы и уравнения
Элементы принято обозначать химическими знаками (символами). Современные химические символы ввел шведский химик Й.Я. Берцелиус (1779 – 1848). Он предложил обозначать элемент первой буквой или первой и одной из последующих букв его латинского названия; первая буква всегда прописная, вторая – строчная. Например, углерод (Carboneum) обозначается буквой С, а хлор (Chlorum) – двумя буквами Cl, т. к. он был открыт позже углерода.
Состав соединений изображается при помощи химических формул, состоящих из символов элементов и подстрочных индексов, показывающих число атомов данного элемента в составе молекулы. Так, формула азотной кислоты HNO 3 показывает, что 1 моль ее включает 1 моль атомов водорода, 1 моль атомов азота, 3 моль атомов кислорода.
Химические реакции записывают с помощью химических уравнений, содержащих формулы исходных и конечных веществ. Формулы исходных веществ располагаются в левой части уравнения, а формулы продуктов реакции – в правой.
Число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым, что достигается с использованием коэффициентов перед формулами веществ. Если коэффициенты в уравнении реакции или индекс в химической формуле вещества равен единице, то они не указываются. Например:
Коэффициенты перед формулами веществ называются стехиометрическими коэффициентами (стехиометрия – раздел химии, изучающий массовые и объемные соотношения между реагирующими веществами).
Равенство чисел атомов каждого элемента в левой и правой частях уравнения химической реакции отражает закон сохранения массы веществ.
2.7. Закон сохранения массы вещества и энергии
Закон сохранения массы веществ впервые сформулирован М.В. Ломоносовым в 1748 г. и независимо от него французским химиком А.Л. Лавуазье в 1789 г.
Масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Например, в реакции:
3Na 2 SO 3 + 2KMnO 4 + H 2 O = 3Na 2 SO 4 + 2MnO 2 + 2KOH.
Массы исходных и конечных веществ составят:
3М(Na 2 SO 3) + 2М(KMnO 4) + 1М(H 2 O) = 3М(Na 2 SO 4) + 2М(MnO 2) + 2М(KOH),
3· 126 + 2· 158 + 18 = 3· 142 + 2· 87 + 2· 56,
т.е. масса исходных веществ (712 г) равна массе продуктов реакции (712 г).
Закон сохранения массы утверждает, что в результате химических превращений атомы не исчезают и не возникают, а происходит их перегруппировка. При этом ядра атомов в химических процессах остаются неизменными, а изменяются только электронные оболочки атомов. Общее число электронов и ядер в химических реакциях остается неизменным. Закон сохранения массы широко используется при проведении стехиометрических расчетов.
Закон сохранения энергии утверждает, что энергия изолированной системы постоянна. В изолированной системе не происходит обмена массой и энергией с окружающей средой, энергия может переходить только из одной формы в другую.
М.В. Ломоносов рассматривал закон сохранения массы веществ и закон сохранения энергии в единстве, как всеобщий закон природы.
Взаимосвязь массы и энергии выражается уравнением Эйнштейна:
в котором Е – энергия, m – масса, с – скорость света в вакууме (с = 3·10 8 м/c). Согласно уравнению Эйнштейна масса материального объекта зависит от его энергии. Изменение массы Δ m можно вычислить если известен тепловой эффект химической реакции Q = Δ E:
Вычислим изменение массы для реакции сгорания 1 моль кремния, при которой выделяется 908,3 кДж теплоты:
Si (к) + O 2(г) = SiO 2(к) ,
D m = D E/c 2 = 908300/3·10 8 = 1,01·10 -11 кг =1,01·10 -8 г.
Проведенный расчет показывает, что при протекании химических реакций изменение массы (дефект массы) очень мало. Это изменение намного меньше погрешностей определения масс, в том числе и молярных. Следовательно, закон сохранения массы в химических реакциях практически выполняется.
Процессы образования ядер из нуклонов (протонов и нейтронов) сопровождаются колоссальными выделениями энергии, в связи с чем вследствие дефекта массы масса атома не равна сумме масс протонов, нейтронов и электронов.
2.8. Закон постоянства состава вещества
Закон постоянства состава впервые сформулировал французский ученый Ж. Пруст в 1808 г.
Каждое чистое вещество независимо от способа его получения всегда имеет один и тот же качественный и количественный состав.
Например, оксид кальция состоит из кальция и кислорода (качественный состав). В СаO содержится 71,43 мас.% кальция и 28,57 мас.% кислорода (количественный состав). Получить оксид кальция можно в результате реакций:
2 Са + О 2 = 2 СаО,
СаСО 3 = СаО + СО 2 ,
Са(ОН) 2 = СаО + Н 2 О,
2 Сa(NO 3) 2 = 2 CaO + 4 NO 2 + O 2 .
Однако независимо от способа получения, чистый оксид кальция будет иметь приведенный выше состав.
Наряду с соединениями постоянного состава (H 2 O, CO 2 и т.д.) существуют соединения переменного состава (ZrN 0,59 , ZrN 0,74 , ZrN 0,89 и т.д.). Первые названы дальтонидами в честь английского ученого Дж. Дальтона , вторые – бертоллидами в честь французского химика К.Л. Бертолле , предсказавшего такие соединения.
В связи с существованием бертоллидов следует уточнить формулировку закона постоянства состава. Если химическое соединение в данном агрегатном состоянии имеет молекулярную структуру, то его химический состав (т.е. состав его молекул) при данном изотопном составе исходных простых веществ остается одним и тем же, независимо от способа его получения.
Состав соединений с атомной, ионной и металлической решеткой зависит от условий получения, т.е. не является постоянным.
Таким образом, закон постоянства состава справедлив только для веществ молекулярного строения.
2.9. Газовые законы. Закон Авогадро. Молярный объем газа
Состояние идеального газа характеризуется следующими параметрами: давлением Р, температурой Т и объемом V. Между этими величинами экспериментально установлены соотношения, которые используются для решения расчетных химических задач, связанных с газообразными веществами.
1. Закон Бойля-Мариотта :
При постоянной температуре PV = const.
2. Закон Гей-Люссака :
При постоянном давлении (V/T)=const.
3. Закон Шарля :
При постоянном объеме (P/T)=const.
В 1834 г. французский химик Б. Клапейрон объединил эти три закона в универсальный газовый закон:
(PV/T)=const, или (P 1 V 1 /T 1)=(P 2 V 2 /T 2).
Уравнение для 1 моль газа было выведено Д.И. Менделеевым в 1874 г.:
где R – универсальная газовая постоянная (R= 8,314 Дж/(моль·К).
Для произвольного количества газа:
PV = nRT = (m/M)RT.
Это общее уравнение состояния идеального газа, в котором n - число моль газа, m – масса газа, а M – его молярная масса, называется уравнением Клапейрона–Менделеева .
В 1811 г. итальянский химик А. Авогадро сформулировал один из важнейших газовых законов, который получил название закона Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одно и то же число молекул.
Важным следствием из закона Авогадро является утверждение: при одинаковых условиях 1 моль любого газа занимает одинаковый объем.
В частности, при нормальных условиях (н. у.) – при температуре Т = 273 К (0 0 С) и давлении Р = 101,325 кПа (1 атм) – 1 моль различных газов занимает объем, равный 22,4 л. Этот объем называется молярным объемом газа.
Следует отметить, что закон Авогадро имеет приближенный характер. Он справедлив лишь для идеальных газов, между молекулами которых отсутствует взаимодействие. Реальные газы не подчиняются этому закону и объем 1 моль реальных газов при н.у. может отличаться от 22,4 л. В качестве примера в табл.2.1 приведены величины молярных объемов некоторых реальных газов при н.у.
Таблица 2.1. Молярные объемы V М некоторых реальных газов при н.у.
Молярный объем газа – это отношение объема вещества к количеству этого вещества:
где V М – молярный объем газа (размерность м 3 /моль или л/моль); V – объем вещества системы; n – количество вещества системы.
Из закона Авогадро следует, что два различных газа одинаковых объемов при одинаковых условиях содержат одинаковое число молекул, а, следовательно, и равные количества вещества.
Отношение массы определенного объема одного газа к массе такого же объема другого газа (взятого при тех же условиях) называется плотностью (D) первого газа по второму:
Закон объемных отношений Гей-Люссака: Объемы реагирующих и образующихся в химических реакциях газов при одинаковых условиях относятся между собой как соответствующие стехиометрические коэффициенты в уравнении реакции.
Рассмотрим реакцию образования аммиака из азота и водорода:
N 2(г) + 3H 2(г) = 2NH 3(г) .
Из уравнения этой реакции следует, что при взаимодействии одного объема азота с тремя объемами водорода образуется 2 объема аммиака, т.е. V(N 2):V(H 2):V(NH 3)=1:3:2. Следовательно, при стехиометрических расчетах газовых реакций количества веществ газов можно заменить их объемами.